前沿进展:通过微生理方法解决药物研发的评估困难—第四届大西洋毒理学研讨会报告(二)
前沿进展:通过微生理方法解决药物研发的评估困难
—第四届大西洋毒理学研讨会报告(二)
Biology-inspired Microphysiological System Approaches to Solve the Prediction Dilemma of Substance Testing
t4 Workshop Report-跨大西洋毒理学智库的报告,该智库由Doerenkamp Zbinden基金会赞助,由巴尔的摩、康斯坦茨和乌得勒支的毒理学负责人合作完成。本文所表达的观点是作者本人的观点,不一定代表他们的工作机构的观点。
May 15, 2016
翻译和整理:北京佰司特科技有限责任公司
最近出现的微生理系统——在体外模仿人体组织、器官和循环生物学的微流控仿生装置——被认为是可能彻底改变如今的药物开发模式。一项近期由美国政府倡议并在欧洲和亚洲开展的研究项目,最近获得了第一个前沿成果:基于微生理系统的人的单器官和多器官工程,在此基础上建立的测试系统有望模拟不同的疾病阶段,并在临床试验之前预测毒性、免疫原性、ADME谱和治疗效果。这一技术将对药物发展的未来产生重大影响。此外,基于微生理系统的分析可能会彻底改变我们当前的模式,对任何新物质(例如用于农业、食品、生态系统或化妆品)的危害进行排序,从而取代目前使用的实验动物模型。来自学术界、工业界和监管机构的36位专家在德国柏林举办了一个集中研讨会(2015年6月),回顾了目前微生理系统的现状,并评估了药物开发周期中广泛的、具有潜力的方法,提出了可行的技术解决方案,建立人的体外生物学的更高水平的技术。此外,会议重点介绍了器官芯片的重要的案例,以及各种国家和国际项目。最后,概述了未来的路线图,允许在全球范围内进行更具预测性和监管认可的物质检测的方法。
2. Microphysiological systems – an expanding toolbox for hazard, safety, disease and efficacy prediction of particulate matter, chemicals and drug candidates
微生理系统-用于微粒物、化学品和候选药物的危害、安全、疾病和效能预测的工具箱
2.3 MPS 的现状
2.3.1 Introduction介绍
任何基于静态细胞培养的测定的技术缺点包括氧气和营养物质对给定 3D 组织大小或单层代谢的限制,以及缺乏动态蛋白质梯度。例如,早在 1968 年就描述了静态培养瓶中原代人肝细胞培养物的氧气限制(McLimans 等人,1968)。微加工和微流体技术,早在 1990 年就作为一门科学学科开始出现(Manz 等人,1990 年),并在 20 世纪末交付了商业化的芯片实验室平台(参见 El-Ali 等人, , 2006 年和 Whitesides, 2006 年的评论),以及与材料科学相关的生物工程的进步使得第一个基于板和芯片的微流体组织培养系统出现,旨在解决上述静态培养的两个局限性,并复制时空、机械和构成这些组织固有生理行为基础的生化线索。 MPS 开发人员从两个不同的角度着手开发,其中一些旨在将营养供应的微流体原理整合到完善的工业高通量兼容静态细胞培养微量滴定孔格式中,一些则试图使完善的工业组织培养生物反应器系统小型化。
基于板的 MPS 开发可容纳具有 96、384 和 1536 孔阵列的传统静态细胞培养微量滴定板,这已成为任何生物实验室的标准选择。微量滴定板具有额外的优势,因为它们已被完全接受为跨行业的标准 [SLAS,2014]。这些平台的出现是基于实验的纯粹性质和生物学中固有的可变性需要大量的对照实验、重复和稀释。此外,分子和细胞生物科学的趋势已经发展到更高的通量方法,在一次实验中测试更多的条件。正是出于这些原因,手动和自动液体处理和读出设备已根据该标准进行设计。此外,板中的大量孔,例如 384、1,536 甚至 3,456,提供了减少细胞和试剂体积的额外优势, 从而降低每次检测的成本。
用于组织和器官建模的基于芯片的微生理系统通常是从传统的工业细胞培养生物反应器修改而来的,方法是试图缩小流体和组织培养室的规模,并使必要的传感器和执行器小型化。自动化动态生物反应器,例如 20 世纪 70 年代初发明的中空纤维生物反应器,通过引入人工毛细血管进行培养基灌注,解决了大规模(高达 1 升组织培养)的氧气和营养供应问题(Knazek,1972 年) ).这些动态灌注组织培养系统后来发展成为功能性长期体外器官等效物,在 20 世纪 90 年代后期作为体外生物人工肝装置引入医学实践(Catapano 和 Gerlach,2007 年;Gerlach,1996 年;Wang 等人,2010 年) .基于这一历史知识,许多动态组织特异性生物反应器设备,例如用于免疫原性测试的人体人工淋巴结, 被小型化用于体外测试目的,以达到每个组织培养规模的较低 mL(Giese 等人,2006)。图 5 说明了用于同时进行的小型化培养箱依赖型动态生物反应器原型
人体免疫组织培养在操作中每个0.5 ml。
不幸的是,在本世纪的第一个十年,较低的 mL 规模仍然需要过多的细胞供应,并且仍然太大,无法以合理的成本进行同时的高内涵测试,这一点变得很明显。这引发了基于芯片的 MPS 的出现,它采用芯片实验室平台将每个组织培养室的组织培养量从微升减少到纳升。这些旨在应用自动泵送系统和电气、光学和机械转导,以相关吞吐量监测和控制独立于自动培养箱的系统中复杂的微小组织培养。
总之,基于板和芯片的 MPS 目前旨在反映生理学相关参数,包括适当的细胞间、细胞间、基质间以及生化和机械信号。这些能力前所未有创造微生理系统的机会,这些系统有可能捕捉疾病出现的动态、修复和再生过程以及药物在人体中的作用。微生理系统开发的最新进展使得启动细胞环境工程和/或肺、心脏、血管、肌肉、骨骼、肝脏、生殖系统、神经系统(包括眼睛)、肠道、皮肤、肠和肾。在本章中,我们报告了受生物学启发的微生理单器官和多器官系统的发展状况及其在物质测试中的应用。此外,我们还介绍了使用 MPS 对疾病进行建模的成就。第 4 章概述了最近将多器官系统推进人体芯片解决方案的举措。
2.3.2 微生理单器官系统的最新进展
CellAsic(Leeetal.,2007a)开发了早期微孔板的微流体细胞培养模式,采用被动重力微流体流方法进行体外组织再生,并应用于人类疾病建模和药物开发。受LukeLee小组工作的启发(Leeetal.,2007b;Hungetal.,2005b),他们开发了一种微孔板,有8个独立的流动单元,不需要管道进行灌流,而是依赖于被动流动。该设备由粘接在玻璃底部的聚二甲基硅氧烷(PDMS)模压微流控层和丙烯酸组成。通过真空管引入细胞,并通过由密集填充的微柱组成的过滤器固定。灌注流是由重力结合精心调节的微流体通道的流体阻力产生的。
HP Medizintechnik GmbHs (Oberschleißheim, Germany)智能微孔板读数仪是一种基于24孔的先进微生理系统,包括自动显微镜、移液机器臂和pH、氧和阻抗的微传感器,并预先安装在培养箱中(Demmeletal.,2015)。它可以用于监测各种细胞类型和原代组织的代谢活力(Kleinhansetal.,2012)和毒理学测试(Wolfetal.,2011)。相对较高的并行性和移液机器臂和显微镜的自动化程度使得MPS具有全自动、无需标记的长期性等优点。然而,所使用的PDMS材料不能与候选药物产生非特异性结合。
美国威斯康星大学麦迪逊分校的Dave Beebe团队开发了一系列基于微孔板的细胞培养设备,包括3D培养板和趋化板(Berthier et al.,2010)。微孔板上共有192个单通道,填充细胞培养凝胶(Meyvantssonetal.,2008)。利用不同大小的液滴在入口和出口处的页面压力差,在凝胶间进行了微流动。类似的微流泵被用于49通道趋化装置中,由一个非常薄的梯度通道连接源通道和出口通道。
荷兰MIMETAS公司最近推出了Organo Plate,由40到96个单独可定位的微流道组成(Jang等人,2015;Moreno等人,2015;Trietschetal.,2013)。Organo Plate利用Phase Guide技术将细胞外基质(ECM)凝胶有序分层,一层接一层。这是一种完全不需要人工膜的共培养方法,同时仍然能够进行组织工程实验。Organo Plate完全没有高吸附性物质,如PDMS,除了标准移液器不需要任何其他操作设备,并通过重力引发的被动流动提供连续灌流。
麻省理工学院(Cambridge,USA)的Linda Griffith小组将基于平板的微流体细胞培养模式引入肝脏模型,并由CN Bio Innovations(London,UK)商业化。Liverchip™系统是一种基于平板的系统,下面将详细描述。在过去的十年中,一波单器官芯片的概念被提出,涵盖了广泛的组织,并被积极地引入生物学研究。他们从不同器官特异性的单细胞类型培养开始,如内皮细胞(YoungandSimmons,2010)、成肌细胞(Guetal.,2004)、肝细胞(Carraroetal.,2008;Goraletal.,2010;Hoetal.,2006;Leclerc等人,2004年;李等人,2007b;Park等人,2008;鲍尔斯等人,2002年;Toh等人,2007;Tohetal.,2009)、神经元(Rheeetal.,2005)、乳腺上皮细胞(Graftonetal.,2011)、脂肪细胞(Nakayamaetal.,2008)和人类胚胎细胞(Chungetal.,2005;洪在al.,2005a;Smith等人,2012;Villa-Diaz等人,2009)。因此,在下一阶段,异型微流控单器官共培养系统将特定器官的关键细胞类型结合到人工功能单元中,更真实地反映了单个器官的各个方面。在过去五年中,器官芯片模型领域的科学活动急剧增加(vandeStolpeetal.,2013)。因此,我们决定以典型的方式强调用于人类肝脏和肺建模的单器官MPS开发,同时让读者参考其他器官和系统的原始MPS文献。基于MPS的肝脏培养已经从动态随机细胞培养成熟到组织复杂度更高的系统。肝脏对机体稳态(如血浆蛋白合成、葡萄糖生物转化)和血液解毒(如尿素、外源性药物代谢)具有独特的重要性,这导致了人类肝脏结构在其最小功能单位——肝小叶的规模上的进化优化。沿着500μm长的约25个以绳状排列的肝细胞进行精确的分区分工,使血液接触时间仅为几秒钟即可进行血液解毒。血浆与肝细胞接触的流体动力学知之甚少。在Disse结构的流动的性质和应用于这些基底外侧表面的肝细胞的力学是有争议的。开窗程度高可能导致流体剪切应力传递到肝细胞。此外,门静脉周围区的窦道直径很小,只有红细胞大小。血细胞通过这些紧密的窦道时还可能调节切应力。到目前为止,已有四种基于MPS的肝脏等效物:随机动态肝细胞单培养、索状肝等效物、内皮窦模型和肝小叶“等效物”(Materneetal.,2015)。图6突出显示了后三种类型的示例。
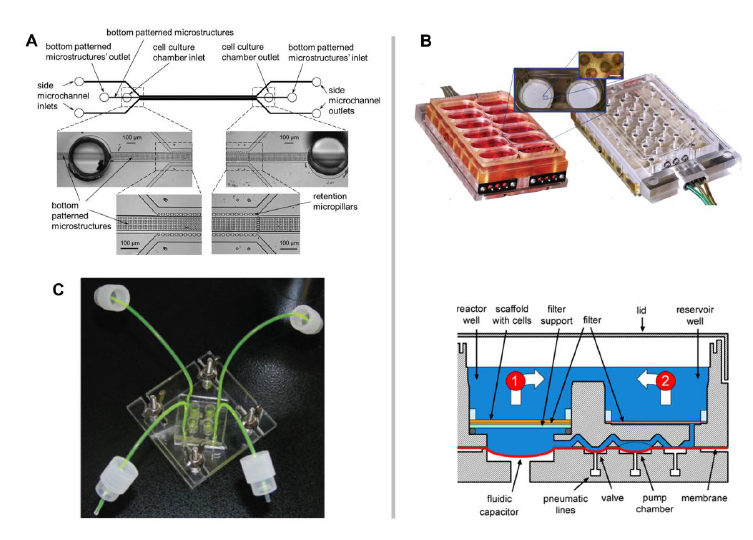
图6:受生物学启发,mps肝模型的复杂性不断增加。MPS从胆管形成的索状肝培养(A),到支持功能空间Disse结构的窦状排列(B),再到维持功能器官状肝结构的组织切片培养(C)。
与随机动态肝细胞培养相反,Goral和同事(2010)提出了由极化细胞组成的三维索状结构,形成延伸的胆管结构。一系列保留柱在两个侧通道之间形成一个微通道(图6a)。然而,与其他基于灌注的微设备不同,细胞培养室底部的微结构提供了额外的肝细胞极性控制。灌注培养两周后,细胞仍能存活并形成索状结构。可以看到胆管结构的延伸和三维结构细胞之间缝隙连接的形成。上述系统允许肝细胞排列成人工的、但类似于索状的集合,恢复肝细胞极性并支持零星的胆汁分离。肝细胞与非实质细胞在持续灌注的三维空间环境中共培养,可能会形成与体内情况下下一个层次的结构相似。Linda Griffith的团队在麻省理工学院(Domansky et al.,2010)开发了一种非常有趣的方法来建模微流控系统中的类正弦结构。多个生物反应器阵列构建在由12个自主微流控系统(图6b)组成的多孔板中,每个孔板由集成的气动微泵灌注,循环总容积为3ml。每个组织培养支架包含769个多通道(0.24mm深,106个大鼠肝细胞与内皮细胞按1:1的比例接种。连续可调的氧气梯度可以建立在长时间的操作时间。支架支持接近生理组织密度和肝细胞功能分区可以规定。支架的大通道支持两种细胞类型在动态条件下的自组装。肝窦内皮细胞在体外已失去分化表型,但在整个培养过程中仍保持功能标记物SE-1的表达。基于氧气消耗模型的可调流量、长期稳定的梯度维持以及肝细胞与不同类型的非实质细胞共培养的能力等重要特性使该系统成为一种有趣的毒性测试方法。这是研究中的多磺酸粘多糖随后得到改进并转化为工业应用的罕见案例之一。由CN Bio Innovations商业化的这个Liver Chip™系统的支架尺寸可以缩放到10,000-1,000,000个细胞,而平板同样缩放到12孔或36孔格式。主动泵送提供循环,使流经组织的流速与组织的形态分离。该系统为药物代谢和药代动力学、毒理学和疾病生物学应用提供高含量数据(Sarkar et al.,2015;Vivares et al.,2015)。它已应用于临床前开发(Dash et al.,2009;Vivares et al.,2015)。此外,在该平台上建立了肝癌细胞微转移模型,并在该模型中建立了侵略性MDA-MB-231细胞系休眠的证明(Wheeler et al.,2014)。使用相同的三维灌注肝脏模型也建立了乙肝病毒感染模型。低温保存的原代人肝细胞通过与病人血清孵育而感染。概述了病毒的整个生命周期,使该模型在探索乙型肝炎病毒的基础生物学和评估新的治疗方法方面发挥效用(Wai et al.,2014)。
建筑的最高水平-整个肝小叶尚未达成,但是芯片微流控方法包含的主要部分已由肝小叶vanMidwoud和他的同事们(van Midwoud et al., 2010),培养3毫克的肝脏切片组织的微流控芯片(图6c)。精密切割的肝切片(厚100μm,直径4mm)在恒定pH和溶解氧的培养箱中以10μl/min的流量灌注。在静态培养3小时以上的对照切片中,生物转化活性是相等的。在三个小时的测量时间内,该系统在代谢功能方面没有显示出任何优势。作者强调了在低组织-液体体积比下连续介质灌注的优势,相对于静态培养中稳定的代谢物积累。不幸的是,目前还没有关于超过72小时的培养表现的数据(van Midwoud et al.,2011a)。
除了上述例子,基于mps的单器官肝脏建模已经导致了大量的芯片肝脏设备(Baudoin et al.,2014a;Hwa et al.,2007;Khetani and Bhatia,2008;Leclerc et al.,2014;Leclercet al.,2015;Legendre et al.,2013;Legendre et al.,2014;Pasirayi et al.,2014;研究工具和分析已经开发出来,用于研究单器官芯片的肝脏代谢和毒性(Baudoin et al.,2014b;Leclerc et al.,2014;Leclerc等人,2015;Legendre et al.,2013;Legendre et al.,2014;Pasirayi et al.,2014;Snouber et al.,2013a)。关于芯片上肝脏模型阅读器开发的更多细节,请参阅各自的综述(Materneetal.,2013;vanMidwoud et al.,2011b)。
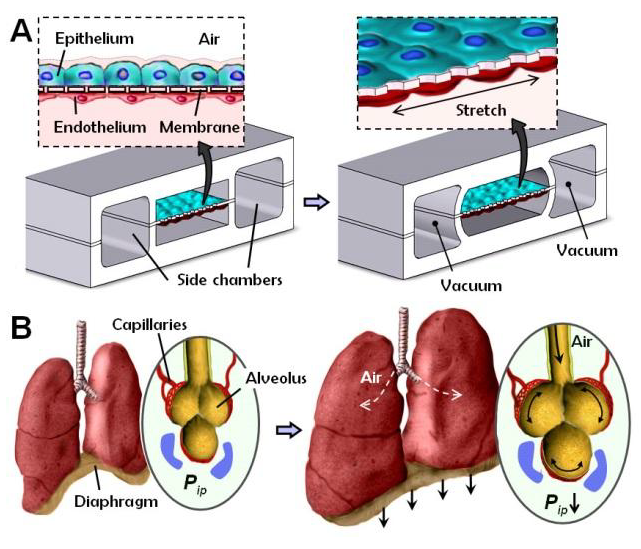
图7:应用机械拉伸的仿生微流控肺泡模型。(A)本机和拉伸状态下的设备横截面图。 膜的顶部培养人肺泡上皮细胞,膜的底部培养人肺微血管内皮细胞。 (B)肺视图,显示吸气时空气的伸展和由此产生的分布。 通过侧腔施加循环真空使细胞层拉伸,模拟吸气时的自然拉伸。 转载自Huh et al.,(2010)。
另一个复杂的器官是人的肺,受生物学启发的MPS模型已经在理解人体器官功能、测试安全性和建模疾病方面发挥了作用。人类小气道和肺泡的体外模型是在细胞培养插入物上静态气液界面培养的历史。对于这些模型的全面概述,读者可以参考Gordon及其同事最近的报告(2015)。直到最近,只有少数试图模拟肺功能部分的MPS被开发出来(Nalayandaetal.,2007;Nalayandaetal.,2010),但是在2010年,由美国马萨诸塞州波士顿哈佛大学Wyss生物启发工程研究所的DonaldIngber小组开发的微生理芯片肺系统首次登上了《科学》杂志(Huhetal.,2010)。图7a显示了这个模拟肺泡功能的系统的设计和原理。该系统是通过微制造两个微通道的腔室来制备的,两个微通道之间由涂覆纤维连接蛋白或胶原蛋白的薄(10μm)多孔PDMS膜隔开。膜上培养人肺泡上皮细胞(上通道),膜下培养人肺微血管内皮细胞(下通道)。空气通过顶部通道泵入,培养液作为血液的替代品通过下部通道泵入。因此,该系统是模拟肺泡-毛细血管屏障。通过在侧通道上施加真空,可以拉伸培养层;真空的释放引起薄膜的弹性反冲,使其回到自然状态,模拟呼吸时肺泡的拉伸(图7b)。空气中的分子通过被动扩散和主动运输的结合穿过培养液层,如肺中的肺泡。Huh和他的同事(2012)使用他们的芯片肺系统开发了一个肺水肿模型。肺水肿是一种危及生命的疾病,与各种疾病或剂量限制药物毒性引起的静压或微血管通透性增加有关(Willett,2014)。Huh和他的同事(2012)证实,给高剂量的白介素-2(IL-2)在他们的芯片肺系统中引起了一种与肺水肿一致的状态,类似于给人类癌症患者使用IL-2的效果。他们还发现,血管生成素-1和GSK2193874(一种瞬态受体电位香草醛离子通道抑制剂)可在体外减轻水肿,并可能在临床环境中阻止IL-2的这种剂量限制毒性。作者得出结论,该系统可以用于其他器官的疾病模型,并预测其他药物在人类中的疗效和毒性。仿真公司(波士顿,美国)正在将基于该平台的工具商业化。该系统还被用于检测细胞内活性氧(ROS)对纳米颗粒的反应(Huh,2015;Huhetal.,2010)。
在这些研究中,直径为12纳米的二氧化硅纳米颗粒诱导并放大了根据活性氧生成测量的急性毒性反应。循环拉伸和松弛多孔膜以模拟呼吸,进一步增强了二氧化硅纳米颗粒从上层空气通道到下层流体通道的吸收和转运。在小鼠全肺通气灌注模型中也观察到类似的结果。
其他研究小组已经开发了一种芯片肺系统,使用的是来自接受部分肺切除术(Stuckietal.,2015)患者的人原发性肺泡上皮细胞或原发性气道上皮细胞(Boletal.,2014;Sellgrenetal.,2014)用于选择治疗肺部病变的候选药物。最后,在芯片小气道模型的基础上建立了化疗诱导的肺水肿模型(Benametal.,2015b)。该系统的主要生物学方面是对细胞施加生理循环应变的应用,这不仅密切模仿正常的呼吸运动,而且影响细胞层的渗透性。体内研究表明,肺的膨胀和吸入一样,增加了肺对亲水分子的渗透性(Marksetal.,1985)。这可能是由于细胞间连接的拉伸,这增加了孔隙的大小,并允许更大的亲水分子通过连接(Masonetal.,2001)。开发用于其他类型上皮细胞培养的微流体系统的创新方法也可能适用于建立新的芯片肺系统。关于mps肺模型发展的进一步信息,请参阅最近的一篇综述(Nicholsetal.,2014)。尽管一致认为芯片上的肺系统是毒理学研究的有用工具,但很少有人使用这些系统进行毒理学研究。
单器官MPS的其他器官模型包括小动脉(Günteretal.,2010)、神经系统(Booth and Kim, 2012;Brownet al.,2014;Kerman et al.,2015;Nery et al.,2015;Park et al.,2009;Taylor et al.,2005),胰腺(Silva et al.,2013;Jun et al.,2013;Lee et al.,2012),肾脏(Snouber et al.,2012;zhang et al.,2013;Ferrel et al.,2012;Kim and Takayama, 2015;Huang et al.,2013;Muetal.,2013)、骨髓(Cuietal.,2007)、皮肤和头发(Ataç et al.,2013)和肠道(Esch et al.,2012;Kim and Ingber,2013;Kim et al.,2012;Kim et al.,2013a;2009;Sungetal.,2011;Yu et al.,2012)在不同层次的生物复杂性。Gao及其同事(2013)设计了一种集成的微流控装置,直接与质谱仪耦合,以实时表征肠道屏障的药物渗透性。他们能够实时测量姜黄素通过Caco-2单层细胞的渗透情况,并获得与已发表的体内数据一致的结果。另一个集成的微流控平台“NutriChip”被建立起来,用于研究乳制品免疫调节功能的潜力(Ramadan et al.,2013)。Ramadan和同事在他们的上皮/免疫细胞共培养模型中,使用磁珠和光学检测设备直接在线量化了促炎细胞因子表达的变化。这些技术为物质渗透性研究或生理反应测量提供了有用的工具。最后,美国波士顿哈佛大学Wyss研究所的芯片肺平台最近被用于炎症性肠病的芯片肠模型(Kim et al.,2016)。该单器官芯片用于共培养与活的人肠道上皮细胞接触的多种共生微生物,并分析肠道微生物组、炎症细胞和蠕动相关的机械变形如何独立促进肠道细菌过度生长和炎症。该体外模型复制了过去动物和人类研究的结果,包括证明益生菌和抗生素治疗可以抑制致病菌诱导的绒毛损伤。在维持管腔血流的同时停止蠕动样运动,缺乏上皮变形可触发细菌过度生长,这与在肠梗阻和炎症性肠病患者中观察到的相似。因此,这种芯片上的人体肠道可以用来分析微生物组对肠道病理生理学的贡献,并以一种可控的方式解剖疾病机制,这是现有的体外系统或动物模型无法实现的。
排泄系统,我们向读者推荐Perestrelo和合作者(2015)最近的一项系统综述,而使用单器官MPS模型疾病已经在其他地方进行了综述(Benametal.,2015a)。荷兰莱顿大学(Leiden University)的Hankemeier及其同事(van Duinen et al.,2015)最近对微流控和微工程3D细胞培养系统进行了一项调查,发现2012年至2015年初在MPS领域发表的大多数组织建模工作都集中在血管系统上。作者解释说,MPS是唯一能够灌注此类血管的平台,因此包括至关重要的血流和伴随的剪切应力,这是血管建模的显著优势。MPS模拟微血管来研究血管生成(Bischel et al.,2013;Zheng et al.,2012)、通透性(Lee et al.,2014)、模式扩散梯度(Baker et al.,2013)、微血管环境(Hasenberg et al.,2015;Kim et al.,2013b;Park et al.,2014;Tourovskaia et al.,2014;Wang et al.,2014a)和血管对血管几何形状的响应(Ye et al.,2014)已经在过去几年发展起来。最后,血管MPS被用作动脉血栓形成的模型(Huh et al.,2007;Westein et al.,2013)。Hankemeier和他的同事(van Duinen et al.,2015)调查的另一个重要发现是,在2012年至2015年初发表的微流控癌症模型与上述微流控组织模型在数值上的份额大致相同。乳腺癌和肺癌模型占已发表癌症模型的一半,最近开发的许多癌症模型都包含血管成分。在这里,MPS技术再次提供了唯一的平台,通过将人微灌注三维肿瘤模型与人血管系统相结合,来模拟肿瘤细胞进入替代血流或免疫细胞外渗到肿瘤中。这些系统增加了我们对肿瘤进展的理解。迁移(Haessler et al.,2012;Hockemeyer et al.,2014)、体内渗滤(Zervantonakis et al.,2012)外渗(Bersini et al.,2014;Jeon et al.,2013)和转移(Griep et al.,2013)已经在这种基于mps的肿瘤模型中进行了研究。
2.3.3 微生理多器官系统的发展
将单器官模型结合到集成的多器官配置中,将复杂性提高到器官相互作用的系统水平。设想使用这种多器官系统来模拟人体器官间的串扰、ADME途径和器官间的系统调节回路。它们的发展对基于板和芯片的格式都提出了重大挑战。不同的器官模型必须在同一设备中处理,同时保持完全功能,并通过相同的循环液相相互作用。这些挑战提高了对使用多器官MPS生成对人类具有可重复性和预测性结果的工具和方法的资格要求。为这些系统模型选择的任何基于板或芯片的MPS技术都是在复杂性和体内相似性与易用性、重现性和并行化潜力之间的权衡(van Midwou et al.,2011b)。瑞士苏黎世联邦理工学院和InSphero AG的Olivier Frey团队及其合作者率先开发了多器官板概念,使用3D微组织球体作为3D组织模型(Kim et al.,2015a;Kim et al.,2015b)。微流控平台的搭建方式是将微组织发育与微流控培养完全解耦,并以模块化方式实现椭球加载(图8A)。平板由直通道组成,连接多达10个相同的隔间,在其中球体可以使用简单的移液加载。介质通过平台周期性倾斜,以重力流的方式在两个横向介质储层之间灌注。单个平板包含多达10个通道,因此在单个倾斜装置上可以测试多达60个多器官条件(图8B)。人体组织球具有固有的器官型功能和仿生形态,可以在离线自动化系统中精确、可靠、灵活地制造。它们的球形形状使其易于操作,并使基于板或芯片的MPS易于操作和耐用的发展成为可能。使用椭球体的多器官排列可以以一种非常灵活的方式建立,对于可以形成椭球体的大量细胞类型,以代表不同的器官模型和许多椭球室的流体互联系统。因此,无需对微流控测试平台本身进行重新设计,就可以对椭球模型进行不断改进和进一步发展。虽然在按照生理顺序安排不同器官模型以及根据引入系统的球体数量调整不同组织体积和比率方面提供了很大的灵活性,但这种方法的局限性在于球体模型本身。球体通常被认为是最小的功能组织单位。然而,很明显,球体不包括机械线索(动态力量,如呼吸紧张),也不血管化。因此,基于球体的多器官模型将主要关注不同组织类型之间的生化和代谢相互作用(例如,将代谢肝脏功能添加到生物激活应用中)。为概念证明(Kim et al.,2015a;Kim et al.,2015b)联合结直肠肿瘤微组织(HCT-116)培养原代大鼠肝组织超过8天。有趣的是,与静态培养条件相比,在流体设备中,大鼠肝脏微组织的白蛋白分泌在最初几天增加,这表明在芯片中流动条件下组织进一步成熟。环磷酰胺是一种前体药物,需要肝脏代谢(主要是CYP2B6)激活才能发挥作用,通过应用环磷酰胺证明了肝脏和肿瘤组织相互连接的重要性。在静态培养条件下,采用移液方案进行离散液体转移,并在芯片上灌注条件下,同时评估环磷酰胺对肿瘤生长的影响。值得注意的是,在静态培养条件下几乎没有观察到对肿瘤生长的任何影响,而在芯片中直接和连续的流体耦合情况下,环磷酰胺处理后微肿瘤明显变小。这些发现说明了不同组织或组织间隔间液体和代谢物连续转移的重要性。在孤立的椭球结构中,这种转移只能通过频繁的离散介质交换来实现。然而,适当的转移时间和足够长的培养时间来获得所需的代谢化合物是很难估计和优化的。此外,相对较大的井量的传统设置可能导致活性代谢物的稀释过大。在同一孔中共培养球形细胞,增加细胞-培养基体积比,短时间内会导致组织不可控融合。研究结果进一步证明,使用已经是劳动密集型的移液协议的井格式无法再现通过连续介质交换获得的结果,正如仅包括两种不同组织类型的设置所示。移液方法不再是需要两种以上不同组织类型的实验方案的选择,因为各自的协议变得非常复杂,而微流控网络提供了可行的解决方案。这种基于板的MPS技术(InSphero, 2012)将由瑞士InSphero公司商业化。
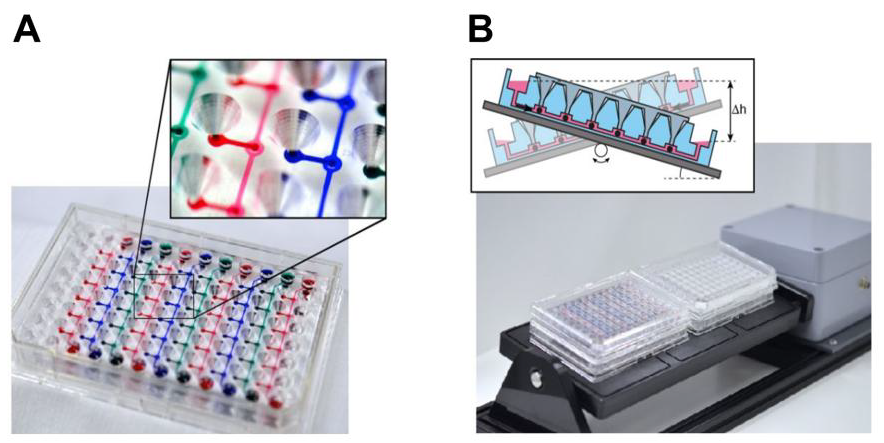
图8:基于平板的多器官系统的例子(A)、96孔格式的多组织相互作用测试芯片(特写显示带有装载端口的球形室)。10条平行微流通道连接6个培养室,可装载不同类型的球体。 (B)、在标准培养箱中操作的平台,使芯片前后倾斜,在不同培养室之间产生重力引导的流动。 (瑞士联邦理工学院ETH提供)
同一组的另一种方法包括使用悬挂滴本身——形成球体的主要技术——作为芯片上培养室(Freyetal.,2014)。悬挂液滴阵列与功能性悬挂液滴网络相连,介质可在液滴之间灌注,并连接不同类型的球体。该平台结合了不同细胞类型球形细胞的形成和培养,由于球形细胞位于液-气界面上,因此不存在粘附和功能丧失的风险。基于阵列的格式能够进行并行的多组织实验,并允许重现上述环磷酰胺生物活化研究。芯片上搏动微泵的集成,其卒中率已与人类ips衍生的心脏球体的跳动同步,最近将心脏“添加到悬挂-滴网络技术中”(Rismani et al.,2015)。
另一种基于平板的系统已被用于研究paracetamol的肠首通代谢和继发性肝脏代谢,使用CaCo-2和HepG2/C3A细胞共培养超过24小时。(Prot et al.,2014)。结果表明,扑热息痛通过肠道单位运输,随后通过肝脏和肠道单位生产硫酸扑热息痛进行协同代谢。肝共培养时检测葡萄糖醛酸对乙酰氨基酚。
美国康奈尔大学的michaelShuler小组率先开发了人体多器官芯片(MOC)。早在2004年,他们就开发了一种基于芯片的微型微细胞培养模拟物(μCCA),用于药代动力学/药效学(PK/PD)建模(Sin et al.,2004)。该系统支持基于生理的药代动力学、定量构效关系(QSAR)研究和定量体外到体内外推(QIVIVE)建模。它将不同的人体组织培养物组合成一个共同的培养基流,用于预测亲代化合物及其代谢物的时间依赖性浓度。系统的原理设计如图9所示。它依赖于普通培养基的再循环,每个培养室约有10,000个细胞,接触物质的次数可达4天。
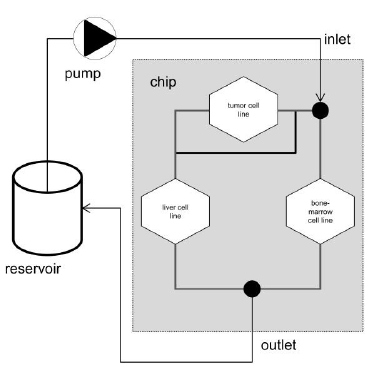
图9:芯片尺寸为25 × 25 mm,通道宽度为20 ~ 100 μm。 流动是层流的,通常每个组织培养室有超过10,000个细胞。 该设计基于哈根泊Poiseulle定律,允许将每个通道中的类人流体速度和液体在每个隔间中的停留时间与硅中的PKPD模型相匹配。 (Marx等人2012年修改)
萘作为模型毒物的研究证明了这一概念(Viravaidya et al.,2004)。此外,两种使用阿霉素(Tatosian and Shuler, 2009)和替加呋(Sung and Shuler, 2009)的联合疗法已经在μCCA的人体癌细胞株上进行了测试,这是专门为物质检测应用而开发的。在选定的规模下,该系统提供了培养室之间的类体内组织质量比,培养基流入分裂,相当于人体各自的血流分裂,以及相关的组织间隔停留时间。此外,该微流控芯片设计据称支持生理剪切应力和液体与细胞的比率,模拟各自的器官。它的运行周期可长达四天。该平台由美国Hμrel公司商业化。μCCA的布局多年来一直在发展(Mahler et al.,2009a;Sung et al.,2010;song and Shuler, 2010)。2012年,将μCCA技术推进为常规检测分析平台,总结了以下问题(Shuler, 2012):
---采用基于重力的介质流的“无泵”芯片设计,避免任何泵系统;
---监控外围的改进;
---有关的机械力或电耦合的维护;
---改进普通培养基,使之成为更逼真的代血剂;
---从3D人类细胞系构建到初级人类类器官的细胞培养室的器官典型性改进,解决其特定的ECM结构、上皮屏障、基质组织影响、生理吸收和水的分泌或蒸发动力学。
Shuler的团队最近提出了一种基于μCCA平台的双器官芯片,通过CaCo-2细胞和粘蛋白产生细胞系TH29-MTX的共培养模拟胃肠道,通过HepG2/C3A细胞系培养模拟肝脏(Esch,2014)。这个肠肝芯片暴露在纳米颗粒中24小时。结果表明,摄入羧基化聚苯乙烯纳米颗粒有可能导致系统肝损伤。下一步,MichaelShulers小组开发了一种用于毒性测试的四器官芯片(Oleago,2016)。最近介绍了一种低成本无泵重力驱动流动系统,用于在一个共同定义的培养基中维持人类心脏、肝脏、骨骼肌和神经元的存活和功能培养两周。选择这些细胞类型是为了深入了解人体组织在应对阿霉素、阿托伐他汀、丙戊酸、对乙酰氨基酚和n-乙酰氨基酚等具有明确毒理学特性的挑战时的重要代谢和功能变化。所提供的数据显示了所有4种人类细胞类型在流动培养14天期间的存活和持续功能,以及它们对单剂量48小时药物暴露的反应。所有药物治疗的结果与已发表的人类和动物数据的毒性结果基本一致。所提出的表型培养模型显示了多器官毒性反应,并向体外“人-芯片”全身毒性筛选试验迈出了一步。Shulers实验室开发的最新原型是一个10个器官的原型,在本报告的第4章中说明。针对不同人体组织在芯片上的系统排列的一系列其他moc已经出现。μOrgano是一种可定制的、类似乐高的即插即用系统,它可以使单个器官芯片系统的初始个体培养和随后的连接创建集成的多器官微生理系统(2015)。作为概念的证明,μOrgano系统被用于串联多个心脏芯片,具有良好的细胞活力和自发的生理跳动率。多组织排列的实验正在进行中。Zhang和来自新加坡生物工程与纳米技术研究所的同事开发了一种多通道3D微流控细胞培养系统,提供了四个独立的基于通道的细胞培养空间,每个空间可以装载数万个细胞(Zhang,2009)。将人肝、肺、肾细胞系和原代人脂肪细胞排列在直接剪切应力屏蔽的微通道中,模拟内皮壁在体内的剪切应力保护。再循环流速为0.2mL/min,暴露时间为2天,转化生长因子β1可导致人肺细胞的独立生物学反应,而其他室则未受影响。Imura和应用生物化学系的同事报道了另一种用于模拟人乳腺癌细胞的肠道吸收、肝脏代谢和毒性反应的综合系统解决方案,该方案使用了常用的四种药物,东京大学农业和生命科学学院(Imura,2010)。他们的系统提供了芯片格式的单向流动,即显微镜载玻片的面积。它支持数以万计的人HEPG2细胞系为基础的肝细胞和人MCF-7细胞系为基础的人乳腺癌细胞连续排列在一个微通道中进行持续灌注。药物通过一个紧密封闭的人cco2细胞系肠道上皮细胞单层提供到肝腔室前通道的介质流中,模拟人体肠道的吸收特性。在0.4μL/min的流速下,暴露时间为2天,对人乳腺癌细胞有离散的生物学效应。异环磷酰胺的肾毒性在肝-肾共培养MPS中进行了超过72小时的研究,与静态比较(Snouber,2013b)。结果表明,在HepaRG-MDCK细胞肝肾微流控共培养模型中,异环磷酰胺的肾毒性是由异环磷酰胺代谢成氯乙醛引起的。本研究展示了多器官系统检测次生代谢物毒性的能力,结合了以人细胞系为基础的肝脏模型和第二个靶器官,在本例中是肾脏。
Gordana Vunjak-Novakovic和她的同事正在开发一种HeLiVa多器官平台,该平台具有从单系人类多能干细胞衍生出来的功能连接血管、肝脏和心脏微组织(Vunjak Novakovic et al.,2013)。从一个供体来源获得多器官系统所需的所有细胞类型的能力是向具有免疫能力的多器官系统发展的一个非常重要的先决条件,以避免该系统中由于供体不相容而产生的器官排斥。该平台能够结合实时生物读数(通过所有三种细胞表型的成像和同源报告)和高通量/高含量分析的兼容性,实现人体生理学的功能表征。用于血管、心脏和肝脏微组织形成和培养的微流体平台的首批原型目前正在评估中,以证明人类iPS细胞衍生的微组织在生理和药理研究中的效用。
为了克服在上述所有泵基moc中使用外部泵和储液器所造成的非生理流体-组织比,柏林科技大学的UweMarx团队和他们的合作者在显微镜载玻片区域的标准化芯片格式下设计并原型化了MOC平台(图10),该平台配备了一个强大的芯片上蠕动微泵,由Wu和同事(2008)改进。
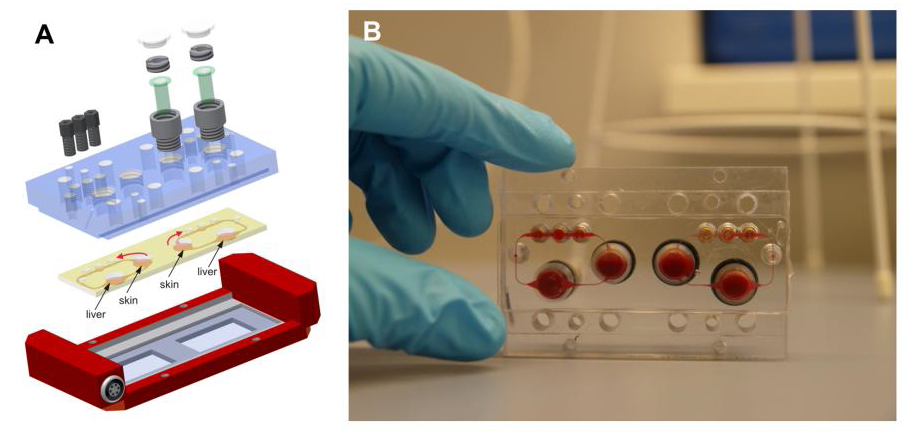
图10:多器官芯片平台(A)一个3毫米高的PDMS芯片(黄色),连接在显微镜载玻片上,承载两个独立的微电路,其循环通道为100 × 500 μm。 每个通道连接两个组织培养室,支持3D组织的整合,如细胞球体和标准96孔插入重建屏障器官模型。蠕动式片上微泵(黑色)可实现生理频率下的脉动单向流体流动。 (B)代表两个血流灌注的回路。(转载自Marx et al.,2012)
它支持介质通过一个、两个或更多的组织培养室以接近活体速率和脉冲频率的脉动再循环。此外,该MOC平台的器官培养室普遍支持3D细胞球体的培养,重建的组织等效物,如培养小室的皮肤或肠,以及供者来源的组织外植体或活检组织。该平台旨在使共培养的人体器官模型在至少28天内保持长期稳态,以实现全身重复暴露于药物中。可以建立一个健壮的、可重复的28天人类HepaRG-Stellate细胞球体与基于插入的人类皮肤活检相连接的共培养过程,每个球体的生物量是原始人体器官对应的1/100,000(Wagner,2013)。在片上共培养过程中,可在气液界面维持皮肤功能。此外,系统中总液体-组织比支持组织串扰,这可以从皮肤消耗肝组织产生的白蛋白看出。最后,共培养显示了对重复剂量暴露宇曲格列酮(一种因药物致肝损伤而退出市场的糖尿病药物)6天的剂量依赖性毒性反应。另一种使用MOC平台的双器官共培养旨在将描述的3D肝脏模型与商业可用的重建人3D小肠模型相结合(Maschmeyer,2015a)。与CaCo-2屏障相比,这旨在增加屏障的人体器官类型,并提高其稳健性和工业适用性。在为期3天的无给药适应期后的11天内,采用了一种可重复且易于执行的口服物质给药方案,从而在重复剂量试验条件下获得连续两周的MOC表现。免疫组化转运蛋白、屏障完整性的经上皮电阻测量和基因表达分析显示,肠屏障功能稳定,而曲格列酮治疗降低了肝球体中白蛋白mRNA的表达。
使用同一平台反复将人肝脏和神经元球体与己二酮进行长期共培养(Materne et al.,2015)。因此,将上述肝球体与人神经元球体共培养14天,使用NT2细胞系在搅拌槽生物反应器中预形成并分化,每天暴露于不同剂量的己二酮中,持续8天。共培养的敏感性谱可以与单器官芯片的反应进行比较,显示出更高的敏感性水平。最后,在生理流体流动条件下,建立了将生物血管系统集成到MOC平台微流体通道中的健壮程序(Schimek,2013)。因此,MOC平台适合于结合人原代或基于细胞系的3D微组织在稳态条件下长期重复剂量物质评估。该产品由德国柏林TissUse公司商业化。快速原型工具允许对moc进行灵活调整以适应任何新格式。因此,28天四器官共培养最近已建立在MOC格式,旨在人类器官型ADMET测试芯片(Maschmeyer,2015)。重建的人小肠与肝球体模型、气液界面皮肤活检和人近端小管细胞单层屏障连接。在28天的共培养过程中,所有的人体组织都保持了较高的细胞活力和离散的生理组织结构。人小肠上皮形成稳定的三维绒毛状结构,高度可达270μm,顶端呈刷状。皮肤活组织检查在气液交界面发现成层角质层。人近端小管上皮维持功能性极化单层屏障。小肠和肾近端小管细胞屏障能够在肠腔、代理血液循环和排泄循环之间保持持续稳定的葡萄糖梯度平衡。此外,深入的代谢和基因分析显示,在所有四种组织之间至少28天内建立了可重复的稳态,独立于用于每个器官当量的单个人类细胞系或组织供体背景。该四器官芯片被设计用于支持物质的ADME分析以及候选药物的重复剂量全身毒性测试。对生理吸收、首次通过代谢、药动学和药效学参数,如有效浓度、最大耐受剂量、时间过程、治疗和不良反应的强度进行评估。最后,该系统可能支持肠和皮肤室的损伤和再生的研究,因为它们在系统中稳定的生理周转。UweMarx实验室MOC的下一步发展是一个10个器官的原型,见本报告第4章。
麻省理工学院的Linda Griffith实验室和哈佛大学Wyss研究所的Donald Ingber实验室正在开发其他集成两个或两个以上器官的多器官系统,由美国国防部高级研究计划局/国家卫生研究院/食品和药物管理局资助。两组患者都向项目评估委员会成功地证明了几种双器官芯片变异(如MIT肝/免疫、肠道/免疫、子宫内膜/上皮和肺/气道MPS)。此外,麻省理工学院团队最近向DARPA/NIH/FDA提交了一个四器官平台的进展,该平台实现了两周的生存能力和功能。美国国防部高级研究计划局/美国国立卫生研究院/美国食品和药物管理局的计划在本报告的第4章中有更详细的描述,这是在开发人体芯片平台的背景下,旨在在体外模拟人体生物学的有机体复杂性。
2.4 MPS 的计算模型、过程控制和读数
使用单个和多个 MPS 的计算和实验范例对于构建生理和药理学相关的 MPS 和相互作用组至关重要。平台上缩放描述了组织重量、介质体积和 MPS 间流速可以基于异速缩放或功能缩放的位置(Stokes 等人,2015)。计算流体动力学模拟计算流量和氧气/药物分布,以及剪切应力(Domansky 等人,2010 年)。
基于生理学的药代动力学 (PBPK) 模型通过预测/分析药物浓度和给定操作参数(例如 MPS 间流速和 MPS 体积)的暴露来研究平台设计和数据解释。 (Yu et al., 2015)。此类 MPS 系统中结果的关联、外推和转换只能通过正确使用各种计算模型来执行。药代动力学参数的体外/体内相关性广泛用于更简单的系统(Brown 等人,2007 年;Obach,1999 年)。 MPS 技术的优越优势开始发挥作用,可以在生物学不太了解的情况下推断药物和器官的相互作用。将系统生物学和药理学模型与来自 MPS 技术的高含量实验数据相结合,将导致体外到体内的转化推进临床结果(Stokes 等人,2015 年)。
基于 MPS 的检测旨在与当前使用的标准测试和方法具有可比性。因此,过程控制和终点分析至少应符合当前黄金标准的要求。对于实验室动物实验——该领域的黄金标准——血液和尿液的日常实验室分析、体温和动物行为的视觉监测是最常见的过程控制。这些可以通过基于 MPS 的测定中的日常培养基分析和生存力测试来匹配。 MPS 的仪器应该能够监测和控制组织培养温度、pH 值和耗氧量。这与例如 LDH 测量和媒体中的葡萄糖消耗分析相结合,为动物的一般行为的目视检查提供了很好的匹配。由于 MPS 的微型尺寸,这些基本过程控制的一个关键方面是可用于分析的介质(血液代用品)数量有限。 动物毒性研究的主要终点是剂量依赖性死亡和尸检后所有相关器官的组织学分析。已经讨论了 MPS 中的可行性评估。动物的器官组织学在一定程度上可以与类似固定、石蜡包埋和染色的组织的组织学分析相匹配,包括蛋白质和其他标记物的免疫荧光染色。动物疾病建模和功效测试应用疾病特异性过程控制(例如血清生物标志物、白细胞监测、活组织检查、神经元电极、脑电图、心电图)和终点分析(例如病理组织学、器官功能恢复)。并非所有这些都可以轻松应用于基于 MPS 的疾病模型。然而,与实验室动物和患者的读数相比,MPS 可以提供更多。
由于它们的微小尺寸、通常以高空间分辨率进行实时光学访问以及对其环境进行基于仪器的严格控制,最终可以在基于 MPS 的器官模型中分析无法在动物或患者身上监测的生物事件。原则上,所有现代组织和细胞分析方法,如 PCR、(甲基化)DNA 和 RNA 测序、mRNA 表达谱分析、蛋白质组学、代谢组学和多重蛋白质分析(例如 Luminex),都可以用于(单个)细胞、组织切片或流过溶液以表征细胞、细胞内过程和组织结构。还可以开发特定于模型的分析,包括通过微电极阵列进行电监测,例如,用于基于 MPS 的心脏或大脑模型。对 MPS 微组织的光学访问允许使用细胞形态和 ECM 结构的 3D 显微成像,以及荧光成像, 两者都具有高分辨率(至少约 1 微米),足以区分细胞中的核或细胞质定位。主要挑战是将足够的聚焦深度与高分辨率相结合。深度为 1-2 毫米的光学相干断层扫描进入组织,具有微米和十分之一秒的空间和时间分辨率,是一个有吸引力的选择。可以应用其他成像技术,例如共焦激光扫描显微镜、双光子或多光子荧光显微镜、拉曼光谱或荧光寿命成像显微镜。
存在各种无标记、非光学方法,并已被证明是监测生命系统的宝贵工具(Fang,2015 年;Wang 和 Liu,2010 年)。细胞外酸化可以用 pH 传感器监测,例如光可寻址电位传感器、离子敏感场效应晶体管、光化学或简单的电位传感器(Brischwein 等人,2009)。溶解氧可以用安培传感器或光化学方法测量。阻抗传感器、石英晶体微天平系统、表面等离子体共振系统和表面声波系统用于监测形态变化。使用微电极阵列监测电生理活性细胞(例如心肌细胞或神经)的活动(Liu 等人,2014 年)。这些无标记方法允许实时、时间分辨地监测细胞参数,这在 MPS 领域可能是一个很大的优势, 因为可以实现对生命系统进行数小时和数天的自动无标签监测。然而,例如荧光标记的使用具有激活受体和改变 MPS 行为的风险(Shinawi 等人,2013 年)。
2.5 MPS 的仪器仪表、原型设计和制造
MPS 由细胞培养部分(板或芯片)和控制和操作细胞培养部分的必要仪器组成:培养箱、泵、倾斜装置、带传感器和执行器的控制单元、光学成像装置和自动移液器。 MPS 仪器的发展挑战已在其他地方进行了审查(Wikswo 等人,2013 年)。片上泵一直是最具挑战性的障碍之一。机电或气压控制的蠕动微型泵被集成到微通道电路中,以实现最大程度的自主操作,并确保培养基循环和交换的低灌注率(Busek 等人,2013 年;Schimek 等人,2013 年)。基于薄膜或微珠荧光指示剂的微型传感器(Liebsch 等人,2000 年;Schmälzlin 等人,2005 年)越来越多地应用于 MPS 中,以监测和控制 dO2、dCO2 或 pH 值。 一些评论总结了神经元和心肌细胞培养物电耦合以记录生理信号和刺激细胞的技术现状(Gosselin,2011 年;Hierlemann 等人,2011 年;Simmons 等人,2012 年;Spira 和 Hai,2013 年) ).早在 2005 年就已经描述了使用微电极在动态微流体环境中神经元细胞的电耦合(Pearce 等人,2005a;Pearce 等人,2005b)。
还描述了在 MPS 中培养的肌肉细胞的电耦合(Agarwal 等人,2013 年;Ahadian 等人,2012 年;Cheng 等人,2006 年;Dvir 等人,2012 年;Grosberg 等人,2012 年;Klauke 等人等人,2003 年、2006 年、2007 年;Werdich 等人,2004 年)。 MPS 可行仪器的一个主要例子是 cellasys(德国 Kronburg)技术(图 11),它采用生物芯片和无标记微传感器测量 pH、溶解氧、阻抗和温度,并用于监测活细胞悬液、粘附单层、原代组织和 3D 球体超过一个月(Weiss 等人,2013 年;Wiest,2015 年)。 6xIMOLA-IVD 由六个测量模块组成,可以并行或串行模式运行。带有蠕动泵、阀门和气泡检测器的计算机控制流体系统允许灵活布置具有 24 个通道的 MPS。这种模块化方法可用于从工具箱中选择不同的单元来构建各种器官芯片设置。

图11:MPS仪器的主要示例(A) BioChip-D (24 x 24 mm²),带有pH值、溶解氧、阻抗和温度的微传感器。(B)传感器制造在透明衬底上,允许附加的光分析方法。计算机控制的6xIMOLA-IVD装置,配有六个测量单元和一个预先安装在培养箱中的自动流体系统(B)。(由德国cellasys GmbH提供)。
MPS 的(主要是一次性的)细胞培养部分的原型设计和制造是该领域的另一个挑战。需要适用于无菌环境中批量制造的经济实惠、易于处理、可靠和可扩展的制造方法,以满足对即用型芯片的需求,最终结合聚合物、金属传感器和固定化生物分子、细胞或组织。由于这些原因,MPS 的制造需要将工程方面与生物功能相结合的多学科方法。相关微系统的一般原则生物学应用已被详细描述 (Ziaie et al., 2004)。对于生命科学中的大多数应用,都在使用聚合物设备。在工业应用中,热塑性材料占据主导地位,因为这是一种可扩展的制造技术,而在学术界,软聚合物 PDMS 是一种广泛使用的材料。在 MPS 领域,制造微流体细胞培养系统的特殊挑战以及基于软 PDMS 的系统与热塑性聚合物系统的优缺点已在其他地方进行了审查(Alrifaiy 等人,2012 年;Andersson 和 van den Berg 2004 年;Berthier等人,2012 年;Huh 等人,2013 年;Kim 等人,2007 年;Park 等人,2003 年;Wu 等人,2010 年)。基于复制的技术,如注射成型或注射压缩成型,是可扩展工业制造的有效选择,在生命科学耗材行业有着悠久的历史记录(Becker 和 Gaertner,2008 年,2012 年)。 图 12 总结了在热塑性聚合物中实现 MPS 的技术链。

图12:聚合物基MPS可扩展工业制造的技术链
起点是系统的设计,然后是实现具有相应微观结构的模具嵌件,随后将被复制。模具嵌件制造是关键过程,因为所有后续制造步骤都依赖于此时生成的模板的质量。生成模具嵌件后,母版将通过注射或注射压缩成型在聚合物中复制,从而实现大批量制造。请记住,这些最初的制造步骤消耗了原型制作或小批量制造成本的 80%,在更高的批量制造规模下,所谓的后端工艺消耗了总成本的 80%。后端工艺总结了一些步骤,例如表面功能化、键合、组装、混合元件的集成,例如膜、传感器、阀门以及干燥和液体试剂。最后一步是质量控制,除了物理检查外,还需要 光学评估等技术,特别是生物试剂的功能控制,最后,特别是细胞或预组装组织,可以运输。考虑到成本结构,制造设计是后来商业成功和新技术渗透到标准实验室生活的关键部分。
对于任何产品开发而言,直接从旨在用于后续产品的材料开始都是有益的。设想使用热塑性聚合物,例如环烯烃聚合物(商品名“Zeonor”)、环烯烃共聚物(商品名“Topas”),或者特别是聚苯乙烯,它是用于细胞培养的培养皿或微量滴定板的标准材料;这些材料也应该用于原型制作。与 MPS 方法起源的生命科学领域的微流体领域类似,使用相同的标准格式:显微镜载玻片的格式 (75.5 x 25.5 mm) 和微量滴定板的格式。这带来了两个主要好处:用于制造的系列工具可用于各种特定于应用程序的设计,因此,即使在中等规模的生产中也不需要更大的投资。此外,可以应用相同的后端工艺制造链, 从一开始就可以通过可扩展的制造技术实现 MPS。在应用方面,这些格式的 MPS 标准化允许使用实验室自动化和筛选领域的完整仪器,即移液机器人、成像系统、孵化和存储元件以及标准显微镜设置。图 13 说明了两种不同的 MPS 格式——芯片和板——使用上述微流体 ChipShop 概述的技术链制造。

图13:微流控板和芯片的硬微加工MPS使用热塑性聚合物制造的芯片和板的示例。具有集成流态界面(A)的显微镜载玻片格式芯片,具有用于芯片上细胞共培养的横流操作膜。一种带有板上储液器的微滴度板大小平台,用于被动流体动力学驱动流体流动(设计HepaChip项目,FKZ 031A121D) (B)。具有不同器官等效物并行片上共培养和片上液体供应的集成MPS动画,包括代谢产物的窗口光学成像(C)。(由德国Microfluidic ChipShop提供。)
微型载玻片形式的芯片需要微结构成型部件、膜集成、顶部和底部与盖板的组装以及表面功能化。通过这种直接可扩展的制造技术,可以实现用于片上细胞共培养的简单设备。左下图展示了一种微量滴定板化装置,它结合了注塑成型、用于电极集成的薄膜技术、表面功能化、生物试剂图案化和与覆盖膜的组装等制造步骤。右侧显示了完成多项任务的集成设备的设计:注塑成型、膜和阀门的集成、液体试剂的实施以及通过嵌入式注射泵的压力驱动流动是图中所示的完全集成 MPS 面临的一些挑战。

北京佰司特科技有限责任公司 (https://www.best-sciences.com):
类器官串联芯片培养仪-HUMIMIC;灌流式细胞组织类器官代谢分析仪-IMOLA;光片显微镜-LSM-200;
蛋白稳定性分析仪-PSA-16;单分子质量光度计-TwoMP;超高速视频级原子力显微镜-HS-AFM;
全自动半导体式细胞计数仪-SOL COUNT;农药残留定量检测仪—BST-100;台式原子力显微镜-ACST-AFM;微纳加工点印仪-NLP2000/DPN5000;
- 2024-04-03
- 2024-04-03
- 2024-03-28
- 2024-03-16
- 2023-10-13
- 2023-10-01
- 2023-09-15
- 2023-09-15
- 2023-09-06
- 2023-09-01
- 2023-08-14
- 2023-08-14
- 2023-08-14
- 2023-08-14
- 2023-08-14
