应用案例:芯片培养的重构人类表皮皮肤类器官
应用案例(类器官培养仪-HUMIMIC):芯片培养的重构人类表皮皮肤类器官
翻译整理:北京佰司特科技有限责任公司
摘要:
医药和个人护理行业需要人体代表模型进行测试,以确保其产品的安全性。物质暴露后渗透到我们体内的主要途径是通过皮肤。我们的目标是为下一代含neopapille (NP)( 毛乳头等效物)的人类皮肤芯片模型的培养条件,并使用敏化剂肉桂醛建立概念验证测试。重建的人类皮肤由成纤维细胞填充的含有新表皮球(RhS-NP)的分层和分化的表皮组成,暴露在空气中,在动态流动下培养10天。研究了三个独立实验的重复性,每个实验都有多达21次的实验内重复。观察到表皮向neopapille球形内陷到水凝胶中。对培养基中乳酸脱氢酶(LDH)和葡萄糖水平的每日测量表明,在所有三个独立实验中以及在一个实验中的重复中,在整个培养期间都有较高的活力和稳定的代谢活性。外用肉桂醛暴露于RhS-NP导致剂量依赖的细胞毒性(增加LDH释放)和接触致敏剂特异性IL-18、促炎IL-1β、炎症IL-23和IFN-γ以及抗炎IL-10和IL-12p70的细胞因子分泌升高。这项研究证明了下一代复杂皮肤模型用于研究皮肤免疫毒性的稳定性和可行性。
1.介绍
医药和个人护理行业需要类人模型进行测试,以确保其产品的安全性。在过去的几年里,这导致了越来越复杂的单器官模型的发展,现在有必要将这些类器官模型结合起来研究系统效应和多器官相互作用。这就需要将这些下一代类器官纳入含有微流体的生物反应器中,这将模拟血管流动,并使在确定的条件下连接不同的类器官成为可能[1]。我们的身体屏障(皮肤、胃肠道、肺)提供了暴露于环境物质的第一个途径,它是一个药物、消费品或有毒物质,因此这样的平台应该总是包含这些器官中的一个。
皮肤组织工程在这一领域处于领先地位,欧盟(EU) 2013年禁止在活体动物中进行化妆品测试,这为[2]创造了巨大的推动力。这一禁令要求快速发展功效和细胞毒性测试的人体皮肤等效物,导致重建的人体皮肤模型越来越接近代表人类皮肤生理[3]。由于皮肤在人体和外界环境之间提供了一道屏障,它不断地暴露在通过角质层和毛囊穿透皮肤的环境化学物质、化妆品和药物中。
已经有人描述过相对简单到复杂的皮肤模型,它们是在静态培养条件下生长的,培养基从下面到达皮肤,表面暴露在空气中,以促进最佳表皮分化和角质层的形成[4-8]。这些模型开始包括表皮,例如含有角质形成细胞、黑色素细胞、朗格汉斯细胞,真皮含有成纤维细胞和内皮细胞,少数情况下还包括脂肪细胞[9-13]。虽然目前市面上有各种可用的皮肤模型被用于危害评估[11],但除了角质层外,还没有重建的人类皮肤模型(RhS)包括毛干穿透途径。此外,这些复杂的皮肤模型还没有被纳入生物反应器中,这将使灌注和代表毛细血管流动的培养基的动态流动成为可能,并将这些皮肤模型与其他类器官联系起来。
许多报告描述了将皮肤模型纳入微流体生物反应器的情况。与静态培养相比,微流体灌注对RhS表皮分化和形态的积极影响被观察到,例如,表皮分化标记物的高表达和增殖的表皮细胞数量较低,类似于天然的人类皮肤[14];观察到在动态流动下培养的表皮角化细胞紧密连接完整性的降低是对紫外线照射[15]的响应;皮肤毒性研究描述局部暴露于基准刺激物(0.2%十二烷基硫酸钠)[16]后屏障完整性下降;以及一种抗癌药物(阿霉素)的全身毒性效应,当应用于循环介质时,再现了临床细胞毒性效应,表现为抑制基底角质细胞在皮肤构建[17]的增殖。上述研究证明了微流控系统通过重现更生理的培养环境来促进体外皮肤屏障模型的潜力。然而,到目前为止,只有相对简单的RhS模型被纳入到不同的生物反应器中。这些RhS以表皮角质层作为外部环境的屏障,但缺乏毛干等其他主要的皮肤渗透途径。由于缺乏这样的主要穿透途径,导致皮肤中物质吸收所涉及的生理事件无法再现[18-21],在局部应用研究中评估表皮屏障功能时,这就变得尤其成问题。
最近,我们描述了表皮凹陷致neopapillae (NP)( 毛乳头等效物),纳入了RhS。这些NP形成的细胞结构存在于毛囊形态发生和毛干形成的初始阶段。毛囊生长的起始和毛干的形成,是形成局部应用于皮肤的活性物质渗透的额外途径的重要一步[18-21]。该RhS-NP模型在静态条件下(无动态流动)培养10天,在此期间观察表皮对NP的内陷。内陷的角质细胞表现出类似于毛囊上皮层的分化特征,角蛋白15和角蛋白10分别表达于外角质细胞层和内角质细胞层。通过信号分子Wnt5a、Wnt10b和LEF1基因表达的升高,可以观察到NP的诱导表型,这些分子在毛囊形态发生的早期表现出特征性的升高。
下一步将是将模拟毛细血管压力的动态流动纳入这个RhS-中NP模型,以便在未来将其与代表我们内部器官的类器官联系起来,以研究突破皮肤屏障的物质的全身毒性效应。本研究的目的是获得稳健的培养条件,在微流控生物反应器HUMIMIC Chip2 (TissUse, Berlin, Germany)中培养RhS-NP 10天。研究重点是获得关于培养物的活力(乳酸脱氢酶释放,这表明多孔细胞膜和细胞毒性)和代谢状态(从培养基中摄取葡萄糖)的广泛的实验内和实验间信息。由于最重要的是,在动态流动下的RhS培养至少对测试物质以及当前的静态模型做出反应,敏化剂肉桂醛被局部应用于RhS和多种(前和抗)炎症细胞因子的释放,包括敏化剂生物标志物IL-18[22],乳酸脱氢酶(LDH)在循环培养基中被确定。
2. 材料与方法
2.1. 人体组织和细胞培养
细胞培养如前所述[23]。角化细胞和真皮成纤维细胞从人幼年包皮中分离,作为常规包皮切除后的休息材料。从人类头皮的枕部和颞部的毛囊单位中分离出毛乳头细胞,主要含有生长的VI期毛囊。毛囊单位从处理过的多余皮肤样本中获得,这些样本来自接受毛发移植手术的成年男性和女性患者。所有皮肤样本均获得德国柏林Charité Universitätsmedizin伦理委员会的知情同意和伦理批准,符合相关法律。
2.2. Neopapillae培养
Neopapillae构造如前面[23]所述。简而言之,3 × 104个毛乳头细胞/cm2被接种到一个含有Neopapillae培养基(Dulbecco 's Modified Eagle 's Medium (DMEM),补充10%胎牛血清(Hyclone Laboratories Inc., Logan, UT, USA)和1%青霉素/链霉菌(Corning, NY, USA)的超低附着6孔板(Corning, NY, USA)中,基本如前所述[24]。在6天的培养过程中,毛乳头细胞自组装成球形,然后进一步被称为新乳突(NP)。在整个培养液中,可以观察到球体致密的球形结构。培养第3天刷新新乳突菌培养基,第6天将NP纳入RhS。
2.3. 用Neopapillae重建的人皮肤(RhS-NP)
RhS-NP培养和所有培养基与前面[23]描述的完全一致。RhS在内径为9毫米、孔径为0.4 μ m的Millicell®插入物中生成(Merck, Darmstadt, Germany)。将成纤维细胞(7 × 104细胞/mL) -NP(每凝胶约90个新皮)填充的水凝胶(鼠尾胶原)移入Millicell®插入物中。在角质细胞培养液i (DMEM/Ham’s F12 (Corning, NY, USA)中以3:1的比例添加5%胎儿克隆III (Hyclone, UT, USA)、1µmol/L氢化可的酮(Sigma-Aldrich, St. Louis, MO, USA)、1µmol/L盐酸异丙肾上腺素(Sigma-Aldrich)、0.1µmol/L胰岛素(Sigma-Aldrich)、2 ng/mL人角质细胞生长因子(Sigma-Aldrich)、1%青霉素/链霉素),将角质形成细胞(6.5 × 104个细胞/水凝胶)接种在水凝胶上,浸泡培养3 ~ 4天。随后,RhS-NP在KC-II培养基(DMEM/Ham’s F12 (Corning, NY, USA)中以3:1的比例,包含1%胎儿克隆III、1µmol/L氢化可的酮、1µmol/L盐酸异丙肾上腺素、0.1µmol/L胰岛素、10µmol/L L肉碱(Sigma-Aldrich, St. Louis, MO, USA)、0.01 mol/L L-丝氨酸(Sigma-Aldrich)、50µg/mL抗坏血酸(Sigma-Aldrich)和1%青霉素/链霉素(Corning, NY, NY)的培养基中进一步培养1至3天。),然后并入HUMMIK Chip2 (TissUse, Berlin, Germany)。
2.4.RhS-NP接种到多器官芯片
将静置培养插入物中的RhS-NP放置在HUM- MIK Chip2的大室中,小室(贮槽)用于更换培养基(图1)。如前文所述,在空气暴露培养的第1 ~ 3天将RhS-NP引入HUMMIK Chip2中[25-27]。将KC-II培养基冲洗至芯片通道后,将相同培养基的200µL移入大室,并将700µL加入储液器中。然后用镊子将RhS-NP小心站立放入芯片的大室中。这导致培养片直接站放置在芯片玻璃载玻片上,而培养基水平只达到transwell膜表面,从而确保HUMMIK Chip2内的气液界面培养。然后用螺旋盖将培养隔间密封起来。然后将芯片连接到微泵(2.5 Hz/微流控电路),并置于37◦C, 5% CO2的培养箱中。每天刷新450µL的储液介质。将RhS-NP暴露在芯片中,动态流动培养10-14天,促进表皮分层和分化。

图1所示。融合在HUMIMIC Chip2中的neopapillae (RhS-NP)重构的人类皮肤。(a)左图显示了HUMIMIC Chip2设备的各个层:带有带有微流控通道的PDMS层的玻片和包含细胞培养室和用于在单个芯片内复制培养的两个独立电路的泵连接器的适配器板。右图从下往上展示了HUMIMIC Chip2:小隔间是培养液的储层,大隔间是RhS-NP的储层。这两个隔室通过充满培养基的微流体通道相互连接。(b)带有片上微泵的HUMIMIC Chip2的宏观视图,产生脉动流量,由控制单元调节。(c)集成在HUMIMIC Chip2器件中的Millicell®细胞培养片中的RhS-NP(内直径9毫米)(培养片中的RhS-NP标记为红色)。
2.5.肉桂醛局部接触动态培养的RhS-NP
在芯片中进行10天的动态空气暴露培养后,将RhS-NP从芯片中取出,并将其短期放置在含有KC-II培养基(1ml /孔)的6孔板中。同时,用不含氢化可的松的KC-II培养基冲洗芯片,以清除旧的培养基残留(氢化可的松是一种免疫抑制培养基成分)。然后用KC-II刷新芯片,储液器中加入700 μ L,培养室中加入200 μ L。Finn Chambers®滤纸盘(8 mm)浸渍25µL肉桂醛(10µM、20µM、40µM、60µM、80µM)。载体为1% DMSO水溶液。去除多余的液体,将过滤器局部放置在RhS-NP的角质层上。对照品中水中含有1% DMSO;RhS-NP对照为不含滤纸盘的未暴露培养物。RhS-NP被转移回到芯片和进一步培养24小时在37◦C,与5%的二氧化碳。在肉桂醛暴露24小时后,收获RhS-NP。
2.6.组织学
RhS-NP用4%甲醛固定,石蜡包埋。石蜡切片(5µm)用苏木精和伊红染色(H&E),用Roti®-Histokitt溶液(Roth)包埋。组织切片使用尼康Eclipse 80i显微镜(Düsseldorf,德国)和NIS元素AR 3.2软件(尼康,东京,日本)拍摄。
2.7.培养上清液的葡萄糖和LDH分析
每天收集培养液(450µL),转移至96孔分析板。葡萄糖、细胞因子珠阵列和ELISA(酶联免疫吸附试验)检测的上清液在−20◦C保存直到进一步使用,而用于ldh测量的上清液在4◦C保存最多4天。所有样品在分析前在4◦C下解冻过夜。384孔板,用于所有的测量,首先处理空气等离子体,以创建疏水板表面。所有样品和标准品都是在重复样品中测量的。试剂盒供应商使用Stanbio葡萄糖LiquiColor®试剂试剂盒(Stanbio Laboratory, Boerne, TX, USA)和细胞毒性检测KitPLUS (Roche Diagnostics GmbH, Mannheim, Germany)测定样品中的葡萄糖和LDH含量。所有吸光度测量均在微平板阅读器(Fluostar Omega, BMG Labtech, Ortenberg, Germany)中进行。
葡萄糖:样品用无葡萄糖培养基1:5稀释。标准样品用两倍连续稀释法制备,得到8个浓度点,范围为0.215-2.295 g/L。以无葡萄糖培养基为空白。将试剂(57µL)和样品(3µL)或标准液移入384孔板的孔中。在室温下,平板在黑暗中以1100转/分振荡15分钟,然后以100× g离心1分钟,用平板读取器在520 nm处测量吸光度,用MARS (BMG Labtech GmbH, Ortenberg, Germany)数据分析软件分析数据。
LDH:标准溶液在PBS/1% BSA中连续稀释两倍制备,范围为10 mU/mL - 0.78125 mU/mL,其中PBS/1% BSA为空白。将试剂(12.5µL)和样品(12.5µL)或标准液移入384孔板的孔中。平板在室温下在黑暗中以1100转/分的速度振荡20分钟,然后置于平板阅读器中,在490 nm和680 nm处读取吸光度。数据使用MARS数据分析软件进行分析。计算LDH值为阳性对照的百分比,即裂解RhS-NP样品中LDH总释放量。
2.8.细胞因子分析
IL-6、MCP1、IL-8/CXCL8和IL-18:对RhS-NP培养上清进行酶联免疫吸附试验(elisa)。elisa试剂按照厂家说明书使用。所需的抗体和重组蛋白由R&D Systems, Inc. (Minneapolis, MN, USA)提供IL-6和MCP-1,除了IL-8由Diaclone SAS (Besançon, France)提供和IL-18由MBL (MBL International, wobben, MA, USA)提供。吸光度在450 nm或490 nm处测量,使用酶标仪(ELISA仪Mithras LB 940, Berthold Technologies, Bad Wildbad, Germany)。数据分析使用MicroWin数据分析软件。
IL-1β、IFN-α2、IFN-γ、TNF-α、MCP-1、IL-6、IL-8、IL-10、IL-12p70、IL-17A、IL-18、IL-23、IL-33:上清液根据制造商说明书(BioLegend, San Diego, CA, USA)使用LEGENDplex™人类炎症面板1进行分析。采集在tune NxT流式细胞仪(Thermo Fisher Scientific, Eugene, OR, USA)上进行(激发Y1 (561 nm;50 mW),发射585/16 nm;例如R1 (637 nM;100 mW) em. 670/14 nm)。分析使用LEGENDplex™数据分析软件套件(BioLegend)进行。
2.9.统计分析
进行了三个独立的实验,每个实验代表来自不同供体的细胞,实验内重复三次。数据以平均值或平均值的标准误差(SEM)表示。组间的差异使用Shapiro-Wilk检验来评估正态性,然后是单向方差分析(one-way ANOVA)来检验统计意义;先进行单因素方差分析(Kruskal-Wallis检验),再进行Dunn多重比较检验;使用GraphPad Prism 9软件(GraphPad software Inc., La Jolla, San Diego, CA, USA)的单向方差分析(Friedman test)如图图例所示。当p < 0.05时,差异被认为是显著的。
3.结果
3.1.HUMIMIC Chip2中整合新皮菌重建的人体皮肤组织学
Vahav et al.[23]对传统静态条件下培养的RhS-NP模型进行了广泛的表征和免疫组化描述。本研究的出发点是进一步开发RhS-NP,以实现HUMIMIC Chip内的构建和稳定培养。用于纳入RhS的自组织新乳头球的直径与头皮头发中发现的毛乳头的直径相当,与之前描述的纳入静态RhS- np的那些(平均直径97 μ m;SEM±16.6µm)(图2a)[23]。


图2。动态培养的RhS-NP。(a)在6孔板中培养的新毛球体培养的光学显微镜图像(嵌图显示一个球体),比例尺= 100µm;(b-d)苏木精和伊红-(H&E)染色石蜡切片显示NP位于水凝胶内表皮下(箭头)和在NP附近内陷表皮角质细胞(箭头)。比例尺= 100µm。
从空气暴露培养开始,在动态流下生长10天,RhS发育出分化的表皮,包括基底层、颗粒层和角质化角质细胞层,在成纤维细胞填充的水凝胶中有多个NP球体。此外,与静态培养中观察到的情况类似,在动态培养的RhS-NP中可以看到表皮对NP的内陷,这表明RhS-NP可以成功集成到HUMIMIC Chip2中。图2(罪犯)。
3.2.动态培养过程中葡萄糖消耗和LDH释放的实验间和实验内的低变化
为了确定RhS-NP在动态流动条件下培养13天(实验1)和10天(实验2和3)时的稳定性,我们确定了三个独立重复实验之间的实验间变化。图3显示了3个独立实验在每个时间点最多21次实验内重复的平均值。测定10天培养期间的葡萄糖水平(实验1为第4-13天)。在培养10天期间,所有RhS-NP在培养上清液中显示的葡萄糖水平相似,第一次、第二次和第三次独立实验的10天平均值分别为11.1 mmol/L (SEM±0.38)、8.8 mmol/L (SEM±0.53)、9.4 mmol/L (SEM±0.48)。
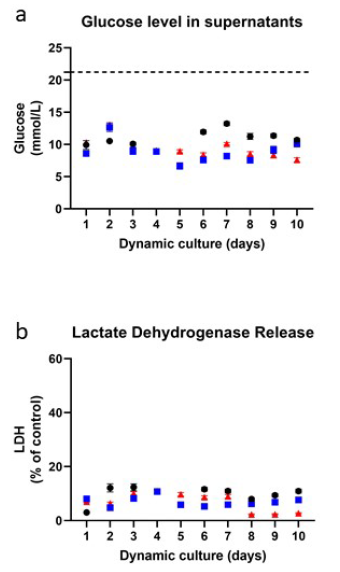
图3。Inter-experiment再现性。(a)上清液中的葡萄糖水平(原始培养基中的葡萄糖浓度以虚线表示)和(b)动态流培养10天以上的RhS-NP上清液中,每天测量乳酸脱氢酶(LDH)释放水平。这些数据代表了三个独立的实验(实验1:黑点;实验2:蓝色方块;实验3:红色三角形),用最多21个实验内重复的平均值±SEM表示。Shapiro-Wilk检验用于评估正态性,单因素方差分析未发现显著差异。
在10天的所有独立实验中,在RhS-NP培养中评估LDH释放(代表细胞膜渗漏和细胞死亡)。第一次重复实验的10天平均LDH释放量略高(9.8%,SEM±1.10),而第二次和第三次重复实验的10天平均LDH释放量几乎相同,分别为7.0% (SEM±0.56)和6.9% (SEM±1.07),强调了实验的重复性RhS-NP培养的生存能力。值得注意的是,在所有情况下,LDH值都非常低,表明在动态流10天期间细胞死亡非常少。
接下来,对第三次重复实验中21个重复的实验内变异进行了深入研究。由于RhS-NP将在此后的3个重复中暴露于不同浓度的肉桂醛,因此RhS-NP批次已经被分为3个重复组。在单次实验中,在LDH(20个重复)和葡萄糖消耗(21个重复)方面,观察到的实验内变化非常小(图4)。在动态流量下,所有RhS-NP在第10天显示出相似的葡萄糖消耗水平,平均为7.6 mmol/L / d (SEM±0.44)。在第10天,LDH水平保持较低,平均值为2.70% (SEM±0.20)。在第1天至第9天也观察到了类似的结果(数据未显示)。此外,在第10天的培养上清中,为了确定RhS-NP的基线分泌,我们测定了细胞因子IL-18的释放,因为这种细胞因子预计会在敏化剂暴露时增加。在过去,我们已经证明,细胞内储存的IL-18只在接触致敏剂暴露时产生,而不是在刺激物或呼吸致敏剂暴露时产生,并且当细胞毒性[22]导致细胞膜渗漏时,细胞内的IL-18被释放到培养上清中。RhS-NP释放稳定、低量的IL-18,范围在6.7-26.4 pg/mL,平均为14.5 pg/mL (SEM±1.2)(图4c)。

图4。动态流培养第10天RhS-NP的实验内重复性评估。测量(a)葡萄糖水平(培养基中的葡萄糖浓度以虚线表示),(b) LDH和(c)单次实验重复RhS-NP上清中细胞因子IL-18的释放。每个黑点代表一个单一的RhS-NP动态培养,培养物已经分组,为剂量反应化学暴露做准备。水平线表示平均值;≤3 intra-experimental复制。单因素方差分析(Kruskal-Wallis检验)未发现显著差异。
综上所述,这些结果表明,在HUMIMIC Chip2中,静态RhS-NP培养已经成功转移到动态流动中,并且在实验内和实验间获得了可靠的可重复性基线数据。
3.3. RhS-NP的局部暴露于增敏剂肉桂醛中
动态流培养10天后,实验3的RhS-NP经角质层外露至增加浓度的肉桂醛或其载体,在动态流下进一步培养24 h(图5a)。暴露于肉桂醛后的RhS-NP的组织学分析显示,包括内陷的表皮层在内的上表皮层明显破坏,伸向新表皮(参见图2b-d和5b)。

图5。从动态流培养第10天开始,肉桂醛局部暴露于RhS-NP上24小时。(a)用滤纸(红色标记)局部应用于RhS-NP角质层的宏观观察。(b)暴露于肉桂醛(60 mmol/L) 24小时的RhS-NP模型的H&E染色。组织学显示肉桂醛穿透内陷表皮和NP破坏的有害影响(cf.图2b-d;未曝光的RhS-NP)。到达基底层的极端破坏用箭头表示,比例尺= 100µm。(c)未暴露的(u)、对照物(v)和暴露的RhS-NP的上清液中LDH水平显示出剂量依赖的细胞毒性,在肉桂醛暴露(24小时)后,致敏剂生物标志物白细胞介素-18 (IL-18)的释放增加。每个黑点代表一个RhS-NP。水平线代表平均值;≤3 intra-experimental复制。采用Shapiro-Wilk检验评估正态性,对LDH进行单因素方差分析(Kruskal-Wallis检验)未发现显著差异;IL-18在80 mmol/L肉桂醛水平时经单因素方差分析(Kruskal-Wallis检验)后经Dunn多重比较检验,差异均有统计学意义,* p < 0.05。
乳酸脱氢酶仅在培养上清中检测到,当细胞毒性导致细胞膜渗漏时。如图5c所示,在未暴露(无滤纸)和载体(水中1% DMSO)浸渍滤纸圆盘中,LDH水平仍然非常低,且相当,说明添加滤纸圆盘和载体对RhS-NP没有细胞毒性。当应用三个最高浓度时,LDH释放以剂量依赖的方式增加,当使用80 mmol/L肉桂醛时,平均达到20%的细胞毒性。在IL-18中也观察到类似的剂量依赖性增加释放,IL-18的显著增加证实了RhS正确地将肉桂醛作为一种敏化剂[22](图5c)。
研究人员进一步研究了局部暴露于肉桂醛后(pro-和anti-)炎性细胞因子(包括趋化因子)释放到微流体小室的情况。80mm的轻微细胞毒性肉桂醛浓度不包括在这一扩展分析中。在研究的12种额外细胞因子中,有8种在试剂盒规格的限度内可检测(表1)。然而,与暴露于载体的RhS-NP相比,炎症细胞因子IL-6、IL-8和MCP-1的水平没有变化,促炎症细胞因子IL-1β、炎症细胞因子IL-23和IFN-γ,以及抗炎细胞因子IL-10和IL-12p70在培养上清液中水平的增加呈剂量依赖趋势。由于21种RhS-NP中有两种由于未知原因而成为某些细胞因子的异常值,因此没有达到统计学意义(图6)。

图6。从动态流培养第10天开始,肉桂醛暴露24 h后,细胞因子释放到培养上清中。促炎细胞因子IL-1β,炎症细胞因子IL-6, IL-8和MCP-1,炎症细胞因子IL-23和IFN-γ,以及抗炎细胞因子IL-10和IL-12p70。每个圆点代表一个RhS-NP。水平线表示三次实验内重复的平均值。单因素方差分析(Friedman检验)未发现显著差异。
4.讨论
我们的结果表明,复杂的静态RhS-NP培养可以成功地转移到HUMIMIC Chip2中的动态流动,并且可以在一个实验内和实验之间实现稳健的基线数据。我们表明,全厚度的RhS- NP可以在模拟我们毛细血管内流动的动态流动下培养至少10天。我们的概念验证研究表明,皮肤致敏剂肉桂醛的毒性测试导致促、抗和炎症细胞因子释放到微流体室。
重要的是,我们的研究集中在复杂皮肤芯片模型的实验内和实验间的可重复性。我们进行了三个独立的实验,每个实验内重复多达21次。这种设置用于预测需要在试验物质的剂量反应研究中进行大量重复的实验。我们的结果表明,在实验内部和实验之间观察到的变化很少,这表明在HUMIMIC Chip2中的动态培养是一种稳健的标准化方法,能够在至少10天内产生可重复性的结果,这是本研究的持续时间。与文献中的其他研究相比(如下所述),实验内和实验间的可重复性通常不被讨论,重复次数往往不被提及或大大降低[14,15,28,29]。许多研究的重点是对类器官和脉管系统进行成像,并通过测试一种物质来获得结果,而不是为平台的稳健性提供证据。此外,我们的RhS-NP比纳入芯片的其他皮肤类器官模型更复杂,因为它也包含毛干的前体,这是皮肤中主要的物质渗透路径。
许多研究描述了血管化芯片,因为皮肤模型的血管化对于结构内所有细胞成分的氧气和营养供应至关重要[30-32]。微血管结构已经通过三维(3D)打印技术引入到灌注皮肤模型中。这些研究显示,皮肤模型中打印的通道被内皮细胞包裹,并使用测试分子在渗透性测定中证明了内皮屏障功能[33,34]。与本研究中使用的设备类似,HUMIMIC微流控设备中结合了血管化网络,这是在之前的研究中通过将人类内皮细胞覆盖在微流控通道上实现的,内皮细胞通过对准芯片[35]内流体流动的方向做出反应。将含有脂肪基质细胞和内皮细胞的纤维蛋白支架植入培养室,形成微血管样结构,在动态培养[36]的两周内保持稳定。这些研究强调了在未来使用HUMIMIC平台的研究中,将这种血管网络引入RhS-NP的潜力。
我们的研究是未来多器官芯片平台的垫脚石,该平台将互联复杂的屏障类器官和充分模拟人类生理和疾病所需的内部类器官。包含多个与微通道相互连接的培养隔间的微流控平台已经存在[37,38]。这些平台显示出作为靶器官化合物代谢和药代动力学研究的预测工具的潜力。例如,两器官芯片平台(HUMIMIC Chip2)已被用于人体肝脏等效物的动态培养,其中包括人体皮肤活检或肠道等效物,展示了曲格列酮暴露[39]后对目标器官的自然暴露途径。同样的微流控平台被用于表皮™(重建的人类表皮)和肝球体的共培养,展示了不同的暴露制度(单次或重复局部或全身暴露)对被测化学物质(金合子素和氯菊酯)[40]的药代动力学和药效学的影响。De Mello等人展示了在心-肝芯片平台上对合成皮肤替代物的局部应用如何可以预测经皮药物暴露对肝脏和心脏组织功能的影响[41]。最近,我们描述了一种多器官芯片方法,展示了口腔黏膜局部暴露于已知可以激活免疫系统的金属,这反过来可能会导致皮肤出现过敏性皮疹和炎症[42,43]。重建的人牙龈和重建的人皮肤含有融合在表皮的MUTZ-3衍生朗格汉斯细胞(RHS-LC),通过动态流动连接到HUMIMIC Chip3plus中。经过24小时的初始培养以实现稳定的动态培养条件后,将敏化剂硫酸镍局部应用于牙龈24小时,并在额外的24小时孵育时间后在RHS-LC中测定LC的激活(成熟和迁移)。镍暴露导致LC激活增加,这可以通过真皮室中CD1a、CD207、HLA-DR和CD86 mRNA水平的增加(RHS-LC水凝胶(PCR))观察到。这是第一项描述多器官环境下的全身免疫毒性和免疫细胞激活的研究。
在我们目前的研究中,外用肉桂醛暴露于动态流培养的RhS-NP导致剂量依赖的细胞毒性(增加LDH释放)和接触致敏剂特异性IL-18、促炎IL-1β、炎性IL-23和IFN-γ,以及抗炎IL-10和IL-12p70的细胞因子分泌升高。只有增加的IL-18释放是显著的,并观察到其他细胞因子的细胞因子释放增加的趋势。这很可能是由于研究的重复次数(3次重复)和因为在剂量反应中观察到两个异常值。值得注意的是,这些异常值在所有研究的细胞因子之间并不一致,并且与相同的RhS-NP样本无关;这些RhS-NP培养物在暴露前的一段时间内也没有显示出LDH释放或葡萄糖摄取的任何变化(图4),因此出现偏差的原因仍然未知。由于本研究的重点是证明实验内和实验间的变异,因此这些异常值在本研究中得到了明确的体现。然而,在进一步的分析标准化之后,如果必要的话,可以达到消除这些异常值的标准(例如,如果三次测试中有两次是一致的,那么如果明确指出,这些异常值可以从最终结果解释中消除)。通过使用LEGENDplex™人类炎症面板1 (BioLegend),只需10 μ L的培养上清液就可以分析13种不同的细胞因子,从而克服了微流控芯片通常获得的小体积的限制。然而,三种细胞因子(MCP-1, IL-6和IL-8)的水平超出了范围(过高),因此必须通过ELISA定量,四种细胞因子(IFN-α2, TNF-α, IL-17A, IL-33)的水平低于该方法的检测限。
在目前的研究中,为了确保系统可以被氢化可的松无介质彻底冲洗,以避免氢化可的松诱导的细胞因子释放的免疫抑制,从HUMMIC chip2中去除RhS-NP。在将RhS-NP替换到芯片中之前,我们利用这个机会局部应用了肉桂醛。这种无氢化可的松介质的茶点是否必要还有待确定。如果不是,那么在未来,RhS-NP可能会在化学处理期间留在芯片中,这意味着额外的处理。我们的研究和其他人的研究的主要限制是样本量。在我们的研究中,9 mm直径的RhS-NP被纳入到HUMMIC chip2中,循环微流体和储液器的总培养基为900µL。组织组织学只能在培养物收获时进行评估,因此,例如,2光子显微技术的进步可以实现实时成像,将大大有助于该领域的研究。此外,需要开发实时传感器和探针来自动量化LDH、葡萄糖和炎症介质(细胞因子),以减少采样和分析所涉及的重要时间,并最大限度地减少进行分析所需的培养基体积。这些进步将使更大规模的实施在未来更加可行。在这些完全实现之前,可以使用多重面板来评估细胞因子和代谢物(蛋白质和RNA)。 未来展望:当将当前研究获得的结果与我们之前从静态RhS培养中获得的结果进行比较时,我们观察到类似程度的稳健性。静态和动态培养均在成纤维细胞填充的水凝胶上显示出分层和分化的表皮,并在暴露于化学物质时分泌细胞因子。在这两种模型中,NP和功能性LC均可纳入RhS[22,23,42,44]。然而,静态和动态的RhS模型目前都有相同的局限性,与所有体外皮肤模型一样,由于培养箱内的潮湿条件(95%的湿度),屏障能力略有受损。未来有可能在动态RhS的上层空气暴露舱引入气流,以降低湿度、干燥角质层、刺激脱屑,进而提高屏障能力,这将是真皮渗透研究和生物利用度向前迈出的重要一步。下一代风险评估的未来在于开发更多具有人体生理代表性的类器官培养物,这些培养物可以集成到多器官平台中。HUMIMIC Chip2生物反应器可以轻松地为多器官培养提供设施,使此类未来的系统性毒性研究成为可能。
北京佰司特科技有限责任公司 (httpswww.best-sciences.com)
类器官串联芯片培养仪-HUMIMIC;灌流式细胞组织类器官代谢分析仪-IMOLA;类器官光片显微镜-LSM-200;
蛋白稳定性分析仪-PSA-16;单分子质量光度计-TwoMP;超高速视频级原子力显微镜-HS-AFM;
全自动半导体式细胞计数仪-SOL COUNT;农药残留定量检测仪—BST-100;台式原子力显微镜-ACST-AFM;微纳加工点印仪-NLP2000DPN5000;
- 2024-12-14
- 2024-12-13
- 2024-11-20
- 2024-11-10
- 2024-11-10
- 2024-11-10
- 2024-11-10
- 2024-11-09
- 2024-11-05
- 2024-11-04
- 2024-10-24
- 2024-10-24
- 2024-10-20
- 2024-10-17
- 2024-10-13
