前沿进展:原子力显微镜技术的最新进展
前沿进展: 原子力显微镜技术的最新进展
一、 什么是AFM
AFM全称Atomic Force Microscope,原子力显微镜,它是继扫描隧道显微镜(Scanning Tunneling Microscope)之后发明的一种具有原子级高分辨的新型仪器,可以在大气和液体环境下对各种材料和样品进行纳米区域的物理性质包括形貌进行探测,或者直接进行纳米操纵。

AFM 原理:针尖与表面原子相互作用
1985年,IBM公司的Binning和Stanford大学的Quate研发出了原子力显微镜(AFM),弥补了STM的不足,可以用来测量任何样品(无论导电性与否)的表面。
AFM利用一个对微弱力极敏感的、在其一端带有一微小针尖的微悬臂,来代替STM隧道针尖,通过探测针尖与样品之间的相互作用力来实现表面成像的。
二、AFM原理
AFM的原理较为简单,它是用微小探针“摸索”样品表面来获得信息。
如下图所示,当针尖接近样品时,针尖受到力的作用使悬臂发生偏转或振幅改变。悬臂的这种变化经检测系统检测后转变成电信号传递给反馈系统和成像系统,记录扫描过程中一系列探针变化就可以获得样品表面信息图像。

AFM是在STM的基础上发展起来的。所不同的是,它不是利用电子隧道效应,而是利用原子之间的范德华力(Van Der Waals Force)作用来呈现样品的表面特性。
假设两个原子一个是在悬臂的探针尖端,另一个是在样本的表面,它们之间的作用力会随距离的改变而变化,其作用力与距离的关系如下图所示,当原子与原子很接近时,彼此电子云斥力的作用大于原子核与电子云之间的吸引力作用,所以整个合力表现为斥力的作用,反之若两原子分开有一定距离时,其电子云斥力的作用小于彼此原子核与电子云之间的吸引力作用,故整个合力表现为引力的作用。原子力显微镜就是利用原子之间微妙的关系来把原子样子给呈现出来。
三 、AFM基本成像模式
原子力显微镜有三种基本成像模式,它们分别是接触式(Contact mode)、非接触式(non-contact mode)、轻敲式(tapping mode)

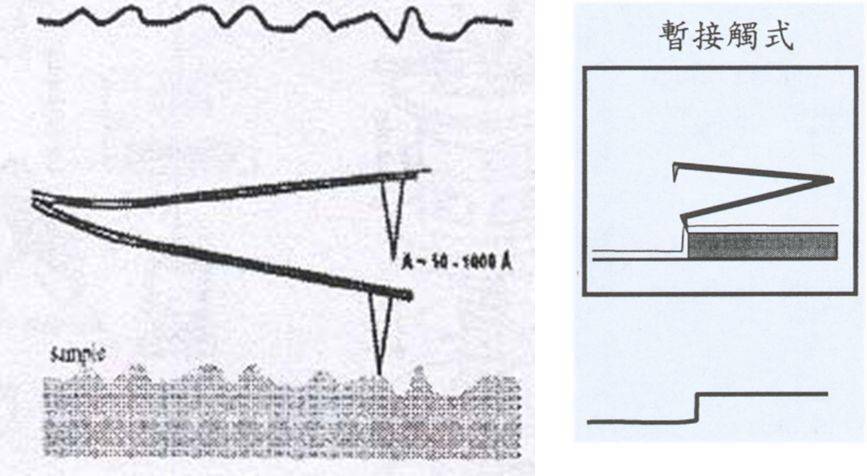
1、接触式
接触式AFM是一个排斥性的模式,探针尖端和样品做柔软性的“实际接触”,当针尖轻轻扫过样品表面时,接触的力量引起悬臂弯曲,进而得到样品的表面图形。由于是接触式扫描,在接触样品时可能会是样品表面弯曲。经过多次扫描后,针尖或者样品有钝化现象。
特点:通常情况下,接触模式都可以产生稳定的、分辨率高的图像。但是这种模式不适用于研究生物大分子、低弹性模量样品以及容易移动和变形的样品。
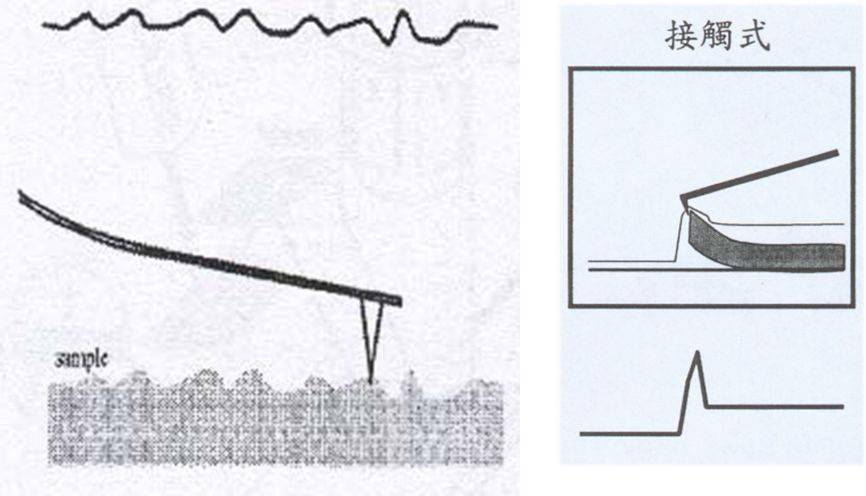
2、非接触式
在非接触模式中,针尖在样品表面的上方振动,始终不与样品接触,探测器检测的是范德华作用力和静电力等对成像样品没有破坏的长程作用力。
需要使用较坚硬的悬臂(防止与样品接触)。所得到的信号更小,需要更灵敏的装置,这种模式虽然增加了显微镜的灵敏度,但当针尖和样品之间的距离较长时,分辨率要比接触模式和轻敲模式都低
特点:由于为非接触状态, 对于研究柔软或有弹性的样品较佳,而且针尖或者样品表面不会有钝化效应,不过会有误判现象。这种模式的操作相对较难,通常不适用于在液体中成像,在生物中的应用也很少。
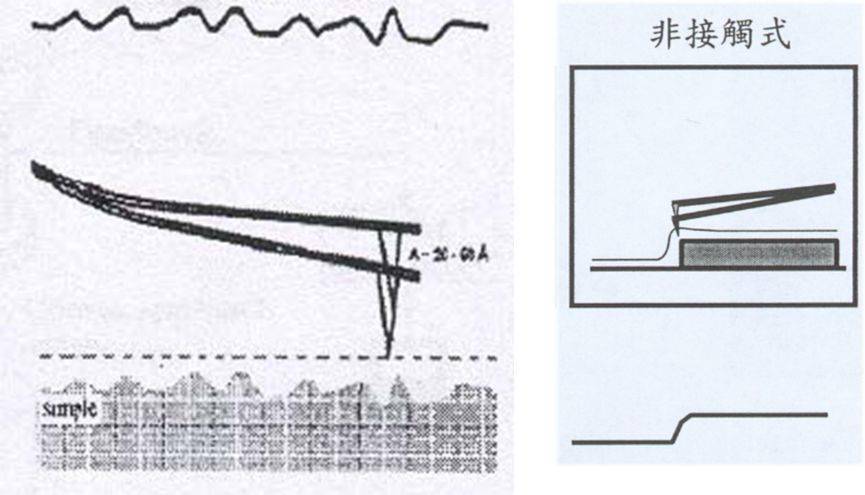
3、轻敲式
微悬臂在其共振频率附近做受迫振动,振荡的针尖轻轻的敲击表面,间断地和样品接触。当针尖与样品不接触时,微悬臂以最大振幅自由振荡。当针尖与样品表面接触时,尽管压电陶瓷片以同样的能量激发微悬臂振荡,但是空间阻碍作用使得微悬臂的振幅减小。反馈系统控制微悬臂的振幅恒定,针尖就跟随表面的起伏上下移动获得形貌信息。
类似非接触式AFM,比非接触式更靠近样品表面。损害样品的可能性比接触式少(不用侧面力,摩擦或者拖拽)。
轻敲模式的分辨率和接触模式一样好,而且由于接触时间非常短暂,针尖与样品的相互作用力很小,通常为1皮牛顿(pN)~1纳牛顿(nN),剪切力引起的分辨率的降低和对样品的破坏几乎消失,所以 适用于对生物大分子、聚合物等软样品进行成像研究
特点:对于一些与基底结合不牢固的样品,轻敲模式与接触模式相比,很大程度地降低了针尖对表面结构的“搬运效应”。样品表面起伏较大的大型扫描比非接触式的更有效。
四、 AFM的分辨率
原子力显微镜分辨率包括侧向分辨率和垂直分辨率。
图像的侧向分辨率决定于两种因素:采集图像的 步宽(Step size)和 针尖形状
1、 步宽因素
原子力显微镜图像由许多点组成,其采点的形式如图所示.扫描器沿着齿形路线进行扫描,计算机以一定的步宽取数据点.以每幅图像取512x 512数据点计算,扫描1μm x1μm尺寸图像得到步宽为2nm(1μm/512)高质量针尖可以提供1~2nm的分辨率.由此可知,在扫描样品尺寸超过1μm x1μm时,AFM的侧向分辨率是由采集图像的步宽决定的。
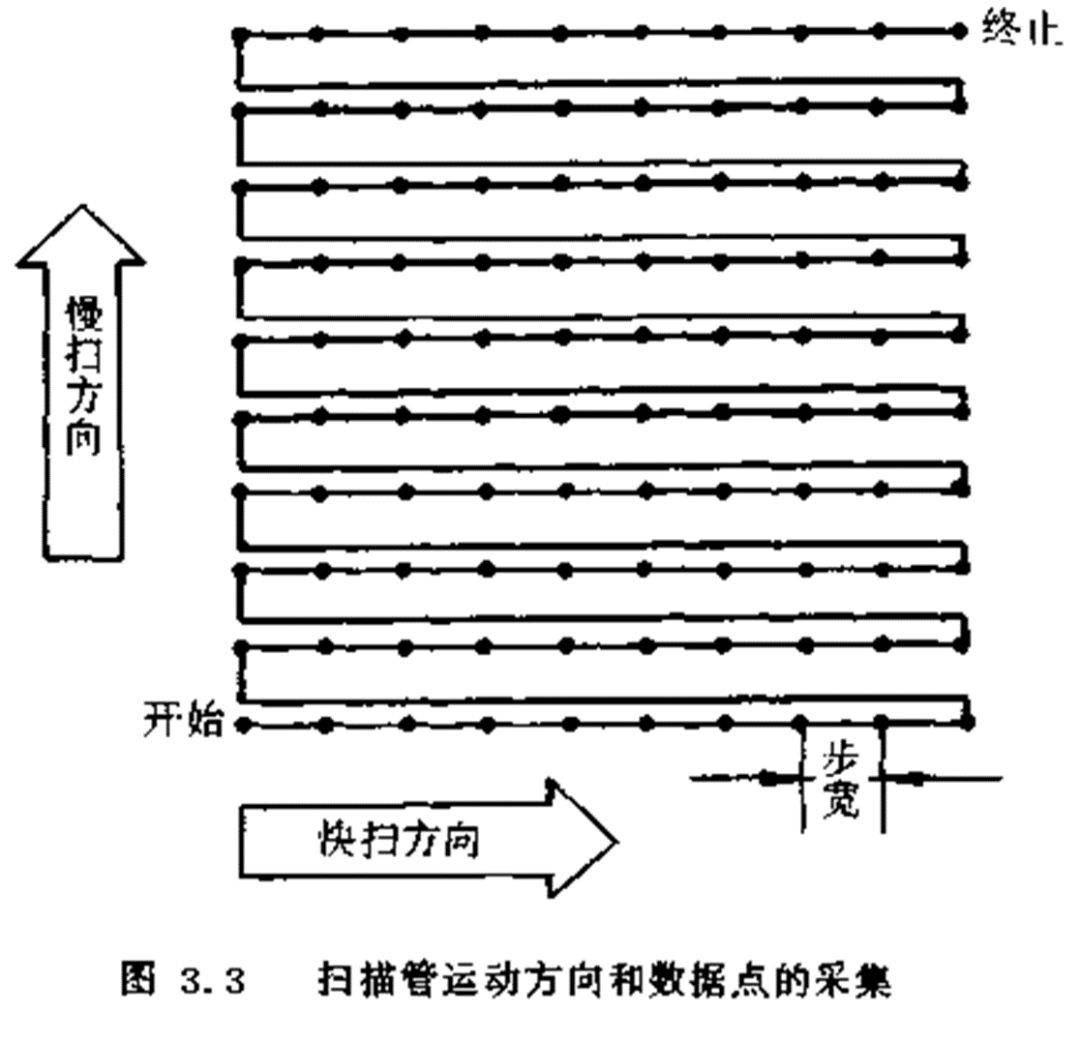
扫描管运动方向和数据点的采集
2、针尖因素
AFM成像实际上是针尖形状与表面形貌作用的结果,针尖的形状是影响侧向分辨率的关键因素。
针尖影响AFM成像主要表现在两个方面: 针尖的曲率半径和 针尖侧面角,曲率半径决定最高侧向分辨率,而探针的侧面角决定最高表面比率特征的探测能力。曲率半径越小,越能分辨精细结构.
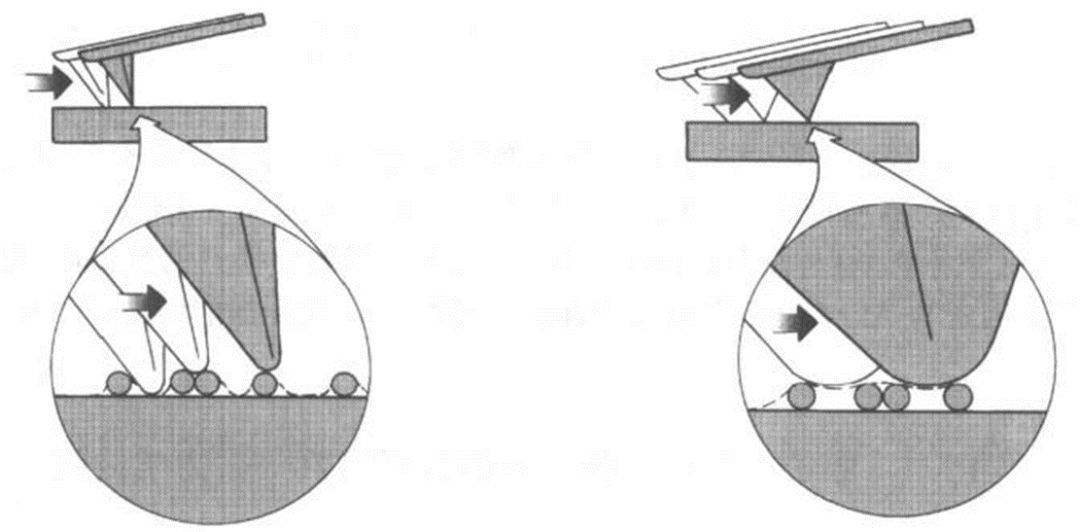
不同曲率半径的针尖对球形物成像时的扫描路线
五、 AFM制样及测试
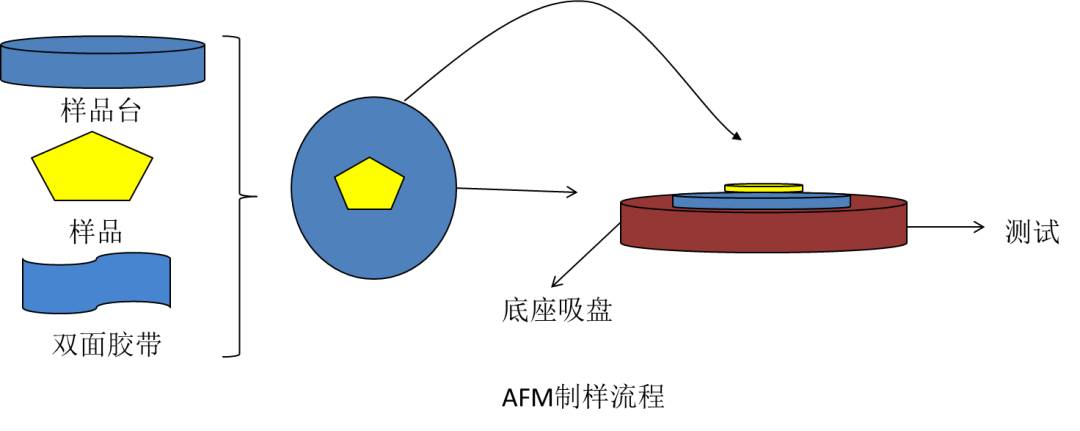
1、 制样流程
AFM制样时,对样品导电与否没有要求,因此测量范围比较广泛。
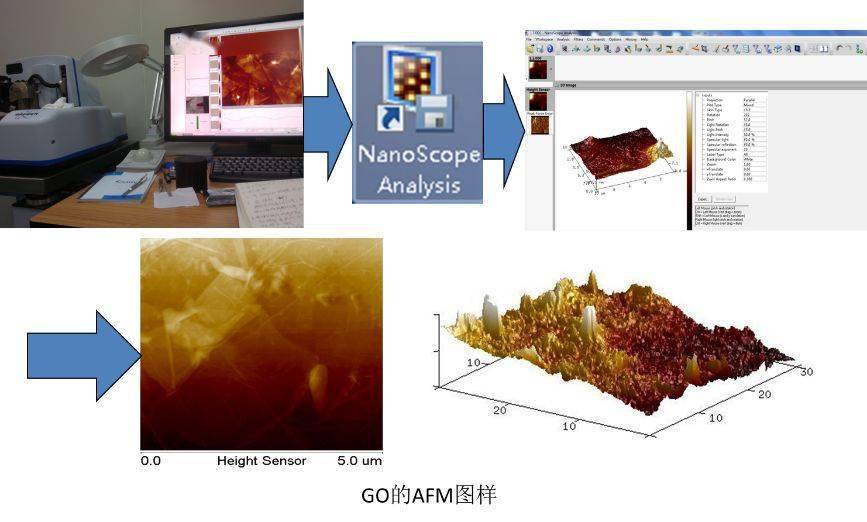
2、 测试及结果分析
以氧化石墨烯AFM结果
六、 AFM应用技术举例
AFM可以在大气、真空、低温和高温、不同气氛以及溶液等各种环境下工作,且不受样品导电性质的限制,因此已获得比STM更为广泛的应用。主要用途:
1. 导体、半导体和绝缘体表面的高分辨成像
2. 生物样品、有机膜的高分辨成像
3. 表面化学反应研究
4. 纳米加工与操纵
5. 超高密度信息存储
6. 分子间力和表面力研究
7 摩擦学及各种力学研究
8 在线检测和质量控制
七、 原子力显微镜可以测量材料物理性质、力学性能、磁学性能、热学性能、电学性能等方面的一些特征信息,但在扫描成像速度上一直存在局限性,太慢的扫描速度导致原子力显微镜无法捕捉到分子间的相互作用过程和一些快速的分子动态变化。
超高速视频级原子力显微镜(High-Speed Atomic Force Microscope,HS-AFM)由日本 Kanazawa 大学 Prof. Ando 教授团队研发,日本RIBM公司(生体分子计测研究所株式会社,Research Institute of Biomolecule Metrology Co., Ltd)商业化的产品,可以达到视频级成像的商业化原子力显微镜。HS-AFM突破了传统原子力显微镜“扫描成像速慢”的限制,能够在液体环境下超快速动态成像,分辨率为纳米水平。样品无需特殊固定,不影响生物分子的活性,尤其适用于生物大分子互作动态观测。超高速视频级原子力显微镜HS-AFM主要有两种型号,SS-NEX样品扫描(Sample-Scanning HS-AFM)以及PS-NEX探针扫描(Probe-Scanning HS-AFM)。推出至今,全球已有150多位用户,发表 SCI 文章 300 余篇,包括Science, Nature, Cell 等顶级杂志。
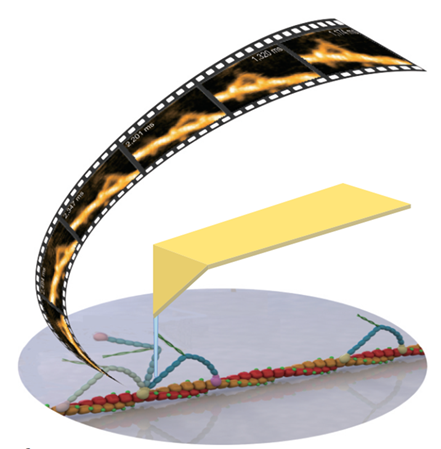
超高速视频级原子力显微镜(High-Speed Atomic Force Microscope,HS-AFM)由日本 Kanazawa 大学 Prof. Ando 教授团队研发,日本RIBM公司(生体分子计测研究所株式会社,Research Institute of Biomolecule Metrology Co., Ltd)商业化的产品,可以达到视频级成像的商业化原子力显微镜。HS-AFM突破了传统原子力显微镜“扫描成像速慢”的限制,能够在液体环境下超快速动态成像,分辨率为纳米水平。样品无需特殊固定,不影响生物分子的活性,尤其适用于生物大分子互作动态观测。超高速视频级原子力显微镜HS-AFM主要有两种型号,SS-NEX样品扫描(Sample-Scanning HS-AFM)以及PS-NEX探针扫描(Probe-Scanning HS-AFM)。推出至今,全球已有150多位用户,发表 SCI 文章 300 余篇,包括Science, Nature, Cell 等顶级杂志。
2023年初1月份,北京佰司特科技有限责任公司正式签约日本RIBM公司的超高速视频级原子力显微镜(HS-AFM),成为日本RIBM公司在中国大陆地区,香港,澳门,台湾以及新加坡的独家代理商,全权负责日本RIBM公司的超高速视频级原子力显微镜(HS-AFM)的市场推广,客户拜访,宣传讲座,路演DEMO,销售定价,投标签约,进出口以及安装售后等所有事宜。

相较于目前市场上的原子力显微镜成像设备,HS-AFM突破了 “扫描成像速慢”的限制,扫描速度高可达 20 frame/s,并且有 4 种扫描台可供选择。样品无需特殊固定染色,不影响生物分子的活性,尤其适用于生物大分子互作动态观测。液体环境下直接检测,超快速动态成像,分辨率为纳米水平。探针小,适用于生物样品;悬臂探针共振频率高,弹簧系数小,避免了对生物样品等的损伤。悬臂探针可自动漂移校准,适用于长时间观测。采用动态PID控制,高速扫描时仍可获得清晰的图像。XY轴分辨率2nm;Z轴分辨率0.5nm。
HS-AFM不仅拥有超高扫描速率与原子级别分辨率,而且具有操作的简易性,使得对单分子动态过程的捕捉变得十分方便,为科研工作者研究和理解生物物理、生物化学、分子生物学、病毒学以及生物医学等领域的单分子动态过程提供了一款强大的工具。
全新的HS-AFM采用了新的高频微悬臂架构,更低噪音、更高稳定性的控制器,高速扫描器,缓冲防震设计,主动阻尼,动态PID,驱动算法优化,多种前沿技术,可以实现在超高速下获取高分辨的生物样品信息。新系统整合了基于工作流程的操作软件,直观的用户界面与流程化、自动化的设置使得研究人员可以专注于实验设计,不需要复杂的操作和条件设置,快速获取数据,加速研究的产出。

日本RIBM公司的超高速视频级原子力显微镜HS-AFM的创新点:
★ 高频微悬臂
弹性系数: 0.1 N/m
曲率半径: <10 nm
共振频率: 400-600kHz in liquid
★ 高速扫描台
20 frames/s. (Standard scanner)
★ 缓冲防震+主动阻尼+动态PID+算法优化
缓冲防震
主动阻尼
动态PID控制:可自动改变反馈增益,保证了HS-AFM在高速扫描条件下仍可获得清晰的图像
探针自动漂移校准,适用于长时间样品观测
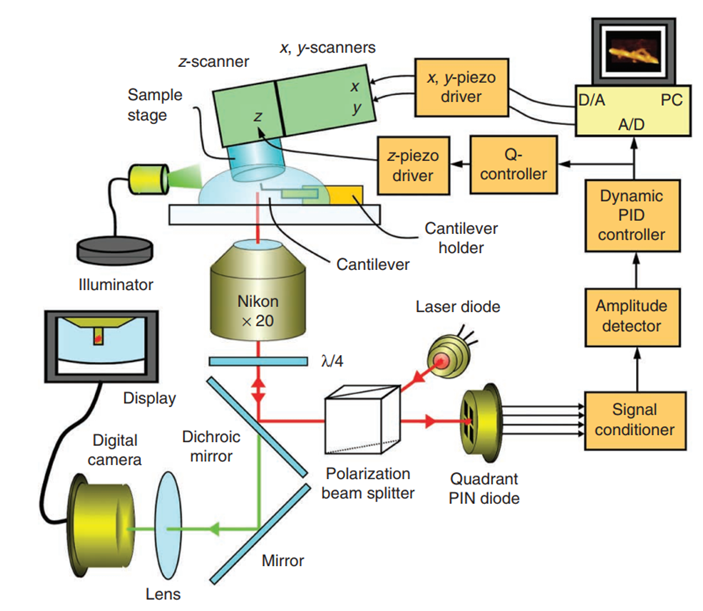
日本RIBM公司的超高速视频级原子力显微镜HS-AFM的的应用领域:
从单分子到单细胞,都可直接观测

1、肌动蛋白
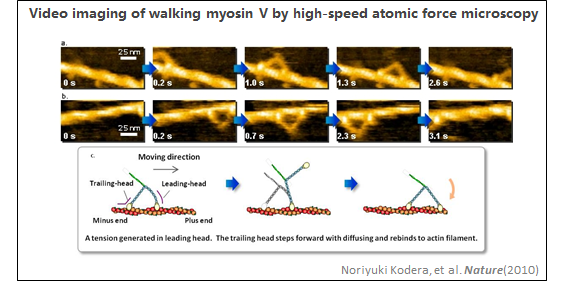
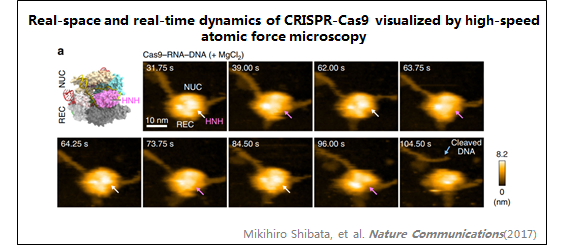
2、CRISPR-Cas9
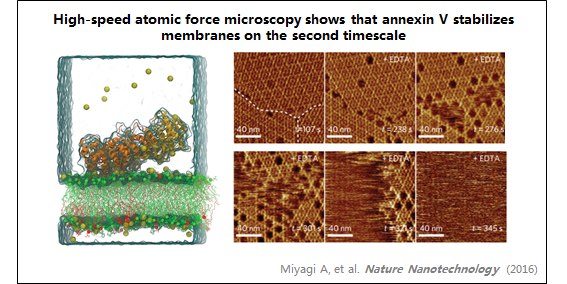
3、膜联蛋白
4、IgG
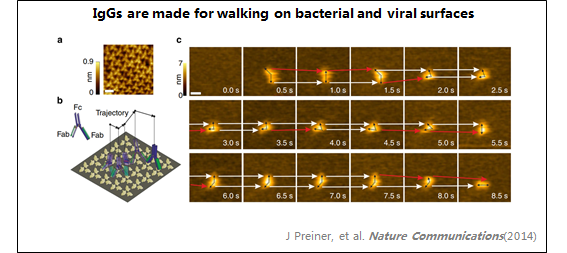
5、活细胞

6、细菌视紫红质

7、DNA纳米结构
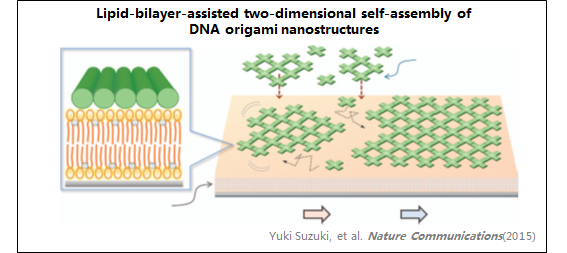
8、仿生聚合物

日本RIBM公司的超高速视频级原子力显微镜HS-AFM的视频案例
1:IgG
在溶液中观察到抗体(IgG)。
IgG呈"Y"形,两个Fab区区分清晰。
由于锚定能力较弱,IgG保持其抗原结合能力。
2:Plasmid DNA
传统AFM在没有强锚定的情况下,DNA分子图像出现摆动。
然而,强锚定可能会削弱真实的结构和行为。
HS-AFM能清晰显示质粒的结构和运动,无强锚定。
3:DNA内切酶的消化:DNase I
DNA酶I是一种随机消化DNA的核酸内切酶。视频中的箭头表示DNase I消化DNA的部分。
请参考从DNA末端消化的核酸外切酶Bal31的视频。
4:DNA外切酶消化:Bal31
Bal31是一种从DNA链末端消化DNA的核酸外切酶。
视频显示Bal31的活性沿着DNA移动,并逐渐从DNA链的末端消化。
最后,DNA分子被完全消化,但环状DNA未被消化。高光点是Bal31分子,它们与DNA的不同位置结合。
5:DNA聚合酶的DNA延伸:Phi29
双链DNA(黄色)随着时间的推移而拉长。单链λDNA作为模具固定在基板上。
由于从随机六聚体引物(Red)结合到λDNA模体,phi29聚合酶(Black)以dNTP为底物合成互补DNA。
6:链亲和素2D晶体中的点缺陷
成功地观察到点缺陷在晶体中的扩散。
从图像上看,两个单空位缺陷的轨迹跟踪相对于晶格的两个轴是明显的各向异性的。
在当今迅速发展的医药领域中,结构生物学以其独特的视角和方法,为药物发现的过程提供了重要的支持。通过深入分析蛋白质和其他生物大分子的三维结构,研究人员能够揭示出分子间复杂的相互作用机制,从而为设计新药提供了坚实的基础。然而,尽管结构生物学的贡献不可小觑,我们也必须认识到它的局限性,并探索如何超越这些限制。
结构生物学展现了分子世界中的精细结构,使我们能够直观地理解生物大分子如何工作。然而,静态的结构图像并不能完全揭示分子在自然状态下的动态性和复杂性。实际上,蛋白质和其他生物大分子在生物体内是处于不断运动和变化中的,这种动态性对其功能至关重要,但用传统的结构生物学方法难以捕捉到蛋白质在生物体内真实的动态变化和复杂环境中的行为。而结构模型,无论是通过实验方法还是计算预测得到的,往往是对这些动态过程的静态快照。因此,我们也需要通过其他方法和技术,来补充和验证这些模型的预测。
结构模型的四个基本挑战结构生物学在药物发现过程中发挥着不可或缺的作用,但它也面临着多个基本挑战,这些挑战可能影响其准确性和应用的广泛性。
结构是模型。无法完全捕捉到蛋白质在生物体内的真实动态性和复杂环境下的行为。对实验数据的误读实验数据是理解生物分子行为的关键,但在解析这些数据时可能会遇到诸多挑战。在某些情况下,实验结构数据的解读可能会受到限制,尤其是在处理低分辨率数据或复杂生物分子系统时。此外,实验条件下获得的结构可能不完全反映生物分子在其自然环境中的状态,从而导致对其功能和相互作用的误解。
描述动态性的困难
蛋白质的运动与药物设计蛋白质的动态性是其功能的重要组成部分,理解这一点对于药物设计至关重要。蛋白质不是静态的结构,而是在其功能执行过程中经历各种形态变化。这些动态变化对于识别药物靶点、优化药物分子与靶标的相互作用以及预测药物的生物活性至关重要。然而,捕捉并描述这种动态性仍然是一个巨大的挑战,尤其是在需要精确预测药物与蛋白质相互作用的情况下。通过高速成像,研究人员可以观察到药物分子与蛋白质相互作用的过程,识别新的药物结合位点,并优化药物分子的设计。
体外研究的误导性重组蛋白与其细胞环境的差异在药物发现的过程中,重组蛋白的使用是解析蛋白质结构和功能的常见手段。然而,这种方法存在一个根本的局限性:它无法完全模拟蛋白质在细胞内的自然状态。重组蛋白质通常在体外表达和纯化,这可能会导致缺乏或错误的翻译后修饰,如磷酸化和糖基化,这些修饰在调节蛋白质功能中扮演着关键角色。此外,体外环境缺少细胞内的相互作用网络,这可能会影响蛋白质的结构稳定性和活性。因此,虽然重组蛋白提供了一个便利的工具,但它们的使用需要谨慎,以避免对蛋白质功能的误解。结构生物学对复杂生物系统的适用性结构生物学在解析单一蛋白质或蛋白质复合体结构方面取得了巨大进展,但其在处理更复杂的生物系统时面临挑战。生物体内的许多重要过程涉及到多个蛋白质和其他生物大分子的相互作用,这些相互作用在空间和时间上高度动态和调节。传统的结构生物学方法往往难以捕捉这种复杂性,尤其是在需要考虑细胞内环境的情况下。因此,发展新的技术和方法,能够在更广泛和更复杂的生物学背景下解析结构信息,对于拓宽结构生物学的应用范围至关重要。
药物与多种受体的相互作用多药效应与不良反应药物在体内往往不仅与其靶蛋白相互作用,还可能与其他多种蛋白质发生相互作用,导致所谓的多药效应。这些额外的相互作用可能会引发不良药物反应,限制药物的有效性或安全性。因此,在药物设计过程中,还需要深入了解这些相互作用对药物作用机制和毒理学影响的生物学背景。"避免组"的结构与影响在药物发现过程中,识别和避免那些可能导致不良反应的蛋白质靶点(即“避免组”)是一项重要任务。
利用结构信息优化药物设计结构基础设计的成功案例过去几十年里,结构生物学的进步为许多重大药物发现提供了关键支持。例如,HIV逆转录酶抑制剂和HCV聚合酶抑制剂的开发,就是基于对这些病毒酶详细结构的深入了解。这些成功案例不仅展示了结构生物学在药物设计中的强大能力,也为未来的药物研发提供了宝贵的经验和启示。面向动态性的设计策略随着对蛋白质动态性理解的深入,结构生物学的应用也在不断进化。传统上,药物设计往往侧重于靶蛋白的静态结构,而忽略了蛋白质在生物体内可能存在的多种构象。近年来,越来越多的研究开始关注蛋白质的动态性和构象多样性,尝试从动态的角度进行药物设计。这种策略不仅有助于识别新的药物靶点,还有助于设计出能够适应靶蛋白动态变化的更为有效的药物分子。
未来结构预测技术的发展
结构预测技术的发展是结构生物学面临的另一个重要挑战。尽管传统方法和AlphaFold等工具已经取得了显著成就,能够以高精度预测蛋白质结构,但仍存在一些局限性,特别是在预测蛋白质在复杂生物系统中的动态行为方面。未来的研究需要进一步提高模型的准确性和适用范围,特别是对于那些结构未知或高度动态的蛋白质。此外,开发能够预测蛋白质复合体结构和蛋白质-药物相互作用的高级模型,将是推动药物发现进程的关键。
北京佰司特科技有限责任公司 (https://www.best-sciences.com/)
类器官串联芯片培养仪—HUMIMIC;灌流式细胞组织类器官代谢分析仪—IMOLA;光片显微镜—LSM-200;
蛋白稳定性分析仪—PSA-16;单分子质量光度计—TwoMP;超高速视频级原子力显微镜—HS-AFM;微流控扩散测量仪—Fluidity One-M;
电荷光度计—illumionONE;全自动半导体式细胞计数仪—SOL COUNT;农药残留定量检测仪—BST-100;台式原子力显微镜—ACST-AFM;微纳加工点印仪—NLP2000DPN5000;
- 2024-11-10
- 2024-11-10
- 2024-11-10
- 2024-11-10
- 2024-11-09
- 2024-11-05
- 2024-11-04
- 2024-10-24
- 2024-10-24
- 2024-10-20
- 2024-10-17
- 2024-10-13
- 2024-09-19
- 2024-09-15
- 2024-09-12
