文献转载:芯片上的患者—多器官串联芯片应用于精准医疗
文献转载:芯片上的患者—多器官串联芯片Multi-Organ-on-Chip应用于精准医疗
翻译整理:北京佰司特科技有限责任公司
An Individual Patient's "Body" on Chips – How Organismoid Theory Can Translate Into Your Personal Precision Therapy Approach
Frontiers in Medicine, 2021, Vol. 8
Marx U, Accastelli E, David R, Erfurth H, Koenig L, Lauster R, Ramme AP, Reinke P, Volk HD, Winter A, Dehne EM
类有机体的概念在12年前就被提出来,当时被称为“芯片上的人体human-on-a-chip”或“芯片上的身体body-on-a-chip”,从“多器官串联芯片Multi-Organ-on-Chip”发展而来,将多个类器官串联起来培养。微生理系统MPS成为体外在生物学上可接受的最小尺度模拟人体生理和形态的技术平台,因此,微生理系统能够以前所未有的精度为每个患者筛选出个性化治疗方案。与此同时,第一个人类类器官——干细胞衍生的复杂三维器官模型,可以在体外扩增和自我组织——已经证明,只要给人类干细胞提供相应诱导分化及生长环境,就可以在体外自我组装成人体类器官。这些早期的类器官可以精确地反映出人体中对应器官的一系列独特的生理状态和病理特征。我们现在把过去的“芯片上的人体human-on-a-chip”的概念发展成“类有机体Organismoid”的理论。首先,我们提出了“类有机体”的概念,即通过体外的自我组装的过程,模仿个体从卵细胞到性成熟的发生过程,培养出的——微小的、无思维、无情感的体外的人体等效物。随后,我们提出了类有机体的分化和培养方法,使其能在体外长时间维持正常功能,以及通过自然或人工诱发疾病干扰类有机体来模拟个体疾病过程。最后,我们讨论了如何使用这一系列健康和疾病模型的类有机体来代替病人,测试药物疗效或药物剂量,即个体化精准医疗。

图1 |每个人个体命运的类有机体。(A)个体发育(黄色)从卵细胞受精开始,随后出生,并在18 ~ 20年后性成熟,发育出功能完整的大脑和成年骨骼。然后,成人的身体会经历一个持续数十年的功能和结构相对稳定的阶段。随着身体年龄的增长,这个成年期会被不断延长的生病和康复期打断(粉色)。情感和意识——人类的灵魂和思想——从童年开始连续发展,并贯穿一生。(B)根据类有机体理论,个性化的类有机体可以通过持续几个月的体外培养(黄色)来建立。由此产生的成体类有机体可以模拟健康人类成年几周(S-短期)、几个月(M-中期)或几年(L-长期)的阶段。然后,这些可以用来模拟急性、亚慢性和慢性疾病时期(粉色)和个体在相应的时间框架内的治疗后恢复。大量相同的类有机体还可以提供足够数量的生物学重复和对照,确保了数据的准确性,真实性,可重复性。此外,这些健康的类有机体在预防医学的评估方面很有用,比如为各自的个体接种疫苗。
类有机体理论
人的个体寿命的特征是人体的生理和形态的发育阶段(发育期)和功能维持阶段(成年期),以及个体与社会在灵魂和思想上的双向交流,如图1A所示。
社会起源本质上与人的大脑的大小和结构有关——大脑由大约860亿个神经元以及数量大致相等的非神经元细胞(2)组成,这些细胞高度连接,聚集在一起处理、整合和协调它从感觉器官接收到的信息(3)—以及它与身体其他部分的相互联系。成熟的人体生理遵循一个简单的进化,即选择性结构计划,也就是组成遵循功能。早在2007年,我们就注意到这样一个事实:“……几乎所有的器官和系统都是由多个相同的、功能独立的结构单元组建成的,从几个细胞层到几毫米组织。由于其独特的功能性、高度的自立性和这些结构单元在各自器官中的多样性,它们对药物和生物制剂的反应模式几乎代表了整个器官。大自然创造了这些微小但复杂的结构单元,以实现器官和系统最主要的功能。在一个特定的器官内,这些结构的重复是天然的风险管理工具,以防止器官局部损伤时功能完全丧失。然而,从进化的角度来看,这一概念使得器官的大小和形状可以很容易地调整到特定物种的需要(例如,小鼠和人类的肝脏使用几乎相同的结构单元)(4)。这一理论,结合微生理系统(MPS)的发展,为在生物芯片上以生物学上可接受的最小尺度模拟人体的器官提供了理论基础(5-7)。2012年,我们引入了“芯片上的人体”(man-on-a-chip)的概念,从“多器官串联芯片Multi-Organ-on-Chip”发展而来,即将多个类器官(比体内缩小10万倍)串联起来培养。我们举例说明了人体主要器官的功能单位,并简要描述了减小尺寸的原理(5)。这是发展一种理论的起点,即建立一种微小的、无思维、无情感的体外的人体等效物,我们现在称之为organismoids类有机体。不同的术语,如芯片上的人体,芯片上的身体,或通用的生理模板,在过去已经被用于代表有机体。在MPS领域中已经使用过这个概念,通过培养10个人的主要器官的等效物(类器官)来实现完整的体内平衡:循环,内分泌,胃肠道,免疫,皮肤,肌肉骨骼,神经,生殖,呼吸和泌尿系统。
基于芯片,串联培养这些器官模型的系统构成了最小的有类有机体,MPS领域预测至少还需要10年才能在芯片上建立这样的功能性类有机体(8,9)。可以用来模拟单个患者的疾病和健康状态,如图1B所示,从而能够为每个患者精确选择正确的药物或疗法和最有效的用药方案。除了用于精准医疗之外,从选定的患者中提取的生物样本还可以进一步用于在芯片上进行临床试验。2018年,毒理学研究前沿论坛(Investigative Toxicology Leaders Forum)讨论了在细胞模型中模拟人类生理学的潜力,该论坛聚集了14家欧洲制药公司的代表(图2)(10)。
类有机体的理论基于两个按时间顺序相互关联的概念,每个概念有三个实施原则。类有机体的体外发育依赖于(i)(诱导多能)干细胞为基础的体外早期类器官形成;(ii)以生理学为基础,通过血液灌流和神经分布,应用于芯片上的MPS,将此类早期器官的比例/数量整合为早期自我维持的类有机体;以及(iii)通过类器官在芯片上的串联培养加速刺激个体发育,完成体外个体发育成为健康成熟的类有机体(模拟成年期)的转变。
因此,利用芯片上的类有机体模拟病人的疾病和治愈过程的概念遵循以下原则:(一)通过自然疾病过程或通过来自病人的病原体或病变组织的传播在生物体中诱发疾病;(ii)通过对同一个患者来源的健康和病变类有机体进行相同数量的试验来模拟对大量患者进行的人体临床试验;以及(iii)为每个患者精确选择正确的药物或疗法和最有效的用药方案。
在这篇文章中,我们带你通过类有机体理论的概念和原则,用实际结果阐述它对我们的医疗保健系统的颠覆性创新的潜力,并提供一个可行性方法的展望。
干细胞和患者来源的类器官教会了我们什么?
一个多世纪以来,科学家们一直对导致体内组织特异性形态发生和器官发生的生化和生物物理线索着迷不已。由于缺乏更多与生理相关的测试系统,他们的研究仅限于经典的细胞培养和动物模型。这些模型极大地增强了我们对细胞功能和疾病机制的基本认识。然而,如何将这些结果转化为人体的数据已经成为一个严重的难题。最近干细胞研究和三维(3D)培养系统的进步已经产生了一种有希望的复杂和完全人源的模型,称为类器官。这些类器官由多能干细胞(PSCs)(诱导PSCs [iPSCs]或胚胎干细胞)、成体干细胞(ASCs)或成体肿瘤组织通过自组织产生。它们在药物发现和个性化医学中的应用已经被验证(11),并提供了生成个性化数据的第一个概念证明(12)。
类器官组织保持其持续增殖和分化为各自器官的不同细胞类型的能力,同时通过仔细调整微环境线索,如模拟体内干细胞生态位,保存干细胞库。与二维单层培养相比,3D类器官培养更紧密地模拟了基因和蛋白质表达以及代谢能力所显示的器官的生理行为。大多数类器官都需要一个基于层粘连蛋白的细胞外基质环境。 而胶原蛋白,相当于体内细胞周围的物理支架。在大多数情况下,这种基质是来源于动物的,没有明确的指标,因此,可能会出现批次到批次的变化(13)。此外,类器官(ASC-或PSC -衍生)的分化过程取决于许多不同的因素,如生长因子、基质、基质刚度、细胞-细胞接触、细胞密度、氧水平、营养供应或体外自组织和细胞命运决定的随机性。因此,在标准的离体培养条件下,类器官的成熟和功能存在高度的异质性。
PSCs衍生的类器官在体外模拟胚胎发育。因此,这些类器官在发育研究中具有重要价值。利用不同的生长因子将PSCs引入相应的胚层——中胚层、内胚层或外胚层。随后,进一步的生长因子混合物被用来诱导细胞形成分化的类器官。在这里,基质蛋白在类器官形成中起着至关重要的作用,经常被用来模拟基底层。

图2 | 在当前的细胞模型图中定位人的类有机体——芯片上的人体等效物(类器官)(10)。
分化的类器官可能由不同类型的细胞组成——上皮细胞和间充质细胞,甚至可能通过内在分化(14)或内皮细胞或中胚层祖细胞的外源性添加获得初始内皮网络(15,16)。培养PSC来源类器官的时间因组织类型而异,通常需要2周至3个月(17),但可以持续半年或更长时间,如皮肤类器官(18)或脑类器官(19)。
患者特异性的PSC来源类器官是通过将体细胞重编程为诱导多能干细胞而产生的。然而,这可能需要几个月的时间。器官类分化的效率在组织类型甚至诱导方案之间差异很大。此外,iPSC衍生的类器官传代的可能性有限。
由于缺乏可用的组织样本,从一些组织(如大脑)的ASCs中很难产生类器官。因此,PSC衍生的类器官对于脑类器官的生成是很有价值的。这些类器官已经在3D球形悬浮培养中培养了长达2年以上,且没有传代(19,20)。
从ASCs衍生的类器官是从具有再生能力的成人组织中产生的。例如,早期人类牙齿或毛囊发育模型在体外应用间充质凝结原理,分别从供体来源的祖细胞中产生基板或真皮乳头类器官(21,22)。然而,只有组织的上皮部分才能被生成类器官。基质细胞、内皮细胞和神经在这些模型中缺失。 ASC衍生的类器官的主要好处在于,它们可能来自健康组织或肿瘤组织。类器官形成ASCs通常只需要几天时间,类器官稳定,可以长期培养和扩张。不同的生长因子组合被用于类器官的扩大和分化,因此,它们可以无限扩大。可以从不同的器官生成来自患者的健康和肿瘤类器官的生物库,在高通量筛查中测试药物,以便对患者的治疗做出进一步的决策(17)。
在过去的十年中,在学术实验室中已经使用这些3D培养方法生成了大量种类繁多的人类类器官。它们的应用和潜力已经得到了广泛的综述(13,17,23 - 25)。表1强调了在体外静态培养中产生类器官的人体器官。然而,传统的静态培养系统无法最终将类器官分化为成熟的、功能完整的器官模型。类器官在形成过程中出现了局部形态梯度,但缺乏稳定的血液灌流推动的生长因子、氧气和其他功能性生化或生物物理因素的浓度梯度。因此,静态培养条件限制了培养时间,因为不断生长的类器官的营养供应和废物清除有限性,限制了它们的成熟度。在下文中,我们将讨论如何通过引入定义的时空因素来提高类器官的成熟度。
表1 |静态体外培养产生的人类器官概述

微流控培养系统——早期类器官形成类有机体的关键
类器官已被证明是模拟不同器官特异性特的有力工具。然而,如上所述,标记物表达和功能往往在早期就停止了。我们从1912年就知道,体外培养的环境决定了它们的生存能力和功能(100)。驱动类器官自组装和分化的各向微环境因子在传统培养条件下相当均匀地覆盖类器官或广泛的表面积,阻碍了由功能驱动的空间定向和成熟。但这些源自相互作用的组织并导致细胞重排的时空线索,是发育成熟器官功能的关键。但这些源自相互作用的组织并导致细胞重排的时空因子,是成熟器官功能发育的关键。特别是内皮组织相互作用及其对器官发生过程中局部信号传导的影响已被广泛研究(101-103)。 例如,发育中的中枢神经系统的血管化是大脑发育中至关重要的一步,确保快速分裂的神经前体细胞的氧气和营养供应。外周神经系统的神经结构已被证明以明显的与血管同步的方式发展。此外,内皮细胞对于维持产生小脑细胞的中枢神经系统胚层的重要性也得到了证明(104)。
此外,在静态培养中控制谱系规格的重组蛋白和小分子主要促进器官内某一特定分段细胞(实质细胞)的发育。其他重要的谱系,如血管、神经元或免疫谱系,大多不存在,因此旁分泌信号可能在进一步成熟过程中变得相关。
允许早产儿类器官与其他器官系统在生理相关尺度上精细协调的系统性相互作用,促进功能对齐和更高的空间分辨率的刺激。大自然的器官组建原件——上述形式描述的最小功能单位,在其多样性中,是一个完整的人体器官。这些重复的亚单位的数量取决于相互作用的器官发出的需求信号。因此,在组织的动态相互作用中,器官的大小、介质流速和液体在器官中的停留时间以及液体与细胞的总体比例会自我调整。
到目前为止,已经设计了几种使组织模型能够进行系统性相互作用的方法——最突出的是患者来源的异种移植(PDX)模型和MPS。在前一种方法中,免疫缺陷或人源化小鼠作为宿主,使主要的肿瘤模型得以移植。移植物与局部和全身环境的相互作用,也通过模型的血管化,最终允许细胞的营养和模型的繁殖。然而,宿主机体和患者组织之间的物种差异阻碍了生物学的完全匹配。在使用这些方法时已经报到了过多的缺点,但也有支持模型的体循环的数据。
在过去的二十年中,通过将器官模型引入MPS来改善器官模型培养条件已经做出了大量的努力。利用原代和细胞系为基础的模型已经建立了MPS中的数十种人体类器官,并已进行了非常详细的综述(105 - 111)。有充分的证据表明,器官功能的成熟可以通过密切模拟有关生化、物理或电刺激的器官型微环境来实现(106)。
一旦意识到这类系统的自体性质是必要的,MPS领域就开始建立芯片上的干细胞衍生模型。表2总结了该领域的最新成就。此外,为创造缺失器官的类有机体被建立起来只是时间问题。
大量种类繁多的其他人体组织和器官模型已经发表。然而,迄今为止,生物芯片内稳态的培养实验未能整合全身成分,如通过血管化微血管的全血供应、个性化(自体)免疫系统和组织神经支配。在这里,我们通过将每个相关器官系统的早期类器官整合到一个自我调节的血管化和神经化的体循环中,扩展了创建基于MPS的类有机体的理论。
我们已经在2012年提出假设,“缺乏器官特定细胞类型之间的动态相互作用,以及它们的血管和基质组织床,以及缺乏用于局部再生的成体干细胞和祖细胞,是当前“芯片上的人体”系统的关键能力缺失的原因”(5)。整个芯片上微流控通道的血管化早在2013年就报道了(132),接下来是关于生成血管化的芯片上类器官的工作(133-136)。截至今天,产生血管化类器官芯片的高通量平台已经上市(137)。这两种技术的结合可以产生包含多个器官的芯片上的封闭血管化通路,从而实现下一个层次的生理复杂性——全血灌注或包含所有相关组成的模型。
生命体理论假设所有关键的全血成分——红细胞、血小板、白细胞和血浆成分——的生成和更新是可行的,并将导致一个自我维持的系统性生命体。因此,一个稳定的功能性芯片上的造血系统是必需的。已经描述了几种使用MPS来模拟基于人类骨髓的造血干细胞生态位的方法(8,138,139)。调整Sieber等人(138)的模型,使其包含对细胞分化和干细胞维持重要的细胞因子,使来自红系、髓系和巨核细胞谱系的细胞能够连续、健壮地生成和维持,同时使干细胞和祖细胞群体维持至少24天(图3)。简而言之,骨髓芯片是按照Sieber等人的描述(138)建立的,但通过修改培养基以包括额外的细胞因子,如Chou等人(139)所述。细胞从循环介质中取样,使用细胞自旋离心机直接沉积在载玻片上,然后使用赖特染色和成像。本研究中所用细胞的供体信息详见表3。
学术界MPS发展概况提供了许多其他指标,可以使用MPS重现血液灌注的特定因子。Westein等人(140)已经证明了模拟血小板诱导的血液凝固的能力,许多文献报道了MPS中的免疫细胞循环以及它们在器官模型芯片上的聚集(141-143)。
一旦将基于生物体的生理全血供应给所有芯片上的类器官,使用自体来源的干细胞衍生类器官的资产就变得与防止免疫系统对外来器官模型的排斥有关。此前发表的多器官系统大多由来自不同供体的组织组成,这使得作为任何人体有机体的主要防御机制的个体免疫系统的无排斥整合成为不可能。早在2013年,一个iPSC供体的几种细胞的自体共培养的第一步就被报道了(144)。iPSC来源的类器官的早熟性提出了这样一个问题:如何最终分化出这些类器官,使其与各自的人类的功能相匹配。在这里,类有机体理论提出了终端芯片上分化的原则,以整合的有机体交流通讯和人为加速的关键器官和系统“训练计划”为指导,如肝脏的外生物物质接触、免疫系统的多抗原接种或性器官加速成熟的类固醇激素人工接触。2019年,基于生理学的4器官芯片首次证明了器官-器官相互作用会触发进一步的芯片上成熟(131),在iPSC衍生的早产儿肝脏模型中,白蛋白和MRP2基因的表达在14天内显著增加,这完全是由与iPSC衍生的肠、肾脏和神经类器官的无分化因子共培养驱动的(图4)。
表2 | 以mps为基础建立的模型为例,再现了人体关键器官的功能

这样的数据支持了生物样体理论的概念,即一旦肝脏功能匹配系统生物样体的需求,就可以通过肠和通过肾脏类器官去除代谢废物将足以维持生物体的功能内稳态。
人体内大部分血浆蛋白由肝脏产生,其中白蛋白浓度约为40 g/L,血浆是目前为止最大的成分。此外,肝脏是毒物和外来物通过食物到达体内的最终的守门员。最后,它在整个循环过程中保持蛋白质、碳水化合物和氨基酸代谢的稳态。大量MPS文献提供了证据,证明由原代或iPSC来源的肝细胞组成的芯片上的人类肝脏类器官能够持续分泌白蛋白和其他蛋白质进入循环(119)。另一个重要的蛋白质成分是白细胞产生的免疫球蛋白G组分,在人的血浆蛋白组分中达到7-16 G /L的生理水平。很少有MPS的目标是在建模免疫组织时产生免疫球蛋白,但一种人工淋巴结在这里已经取得了初步的进展(145)。其他一些器官则向血浆中添加了关键的调节蛋白。胰岛分泌的胰岛素与肝脏相互作用,通过调节葡萄糖的消耗、储存和释放来控制身体以葡萄糖为基础的能量平衡,就是这样一个关键的调节因子。2017年,一种稳定的胰岛-肝脏共培养MPS被建立(146),证明MPS有能力从生理上管理胰岛素的分泌和器官相互作用能力。关于血浆特性,将芯片上产生的血浆蛋白浓度提高到60-80 g/L的生理水平仍然是一个挑战,这是一个非常重要的因素,可以利用白蛋白的生理运输特性,将数百种其他功能蛋白运送到它们的作用位点,并为血细胞运输提供正确的粘度和流动动力学。
通过内皮细胞将器官模型与血液流动完全分离是实现这一目标的基本前提,并将在不久的将来为该领域提供进展。 通过在线传感器密切监测芯片上的代谢活动,通过技术手段对血浆成分进行初步调整,从长远来看,这可能会导致器官模型的提前成熟。在这里,使用自动化系统来保持对芯片培养物的密切观察将成为一个必不可少的组成部分(147)。

图3 | MPS中骨髓细胞维持和分化情况。将人CD34+细胞在人间充质干细胞种子支架上再循环HUMIMIC Chip2培养(A) 17天或(B) 24天,显示分化为红系细胞(第17天),然后是中性粒细胞(第24天)系细胞。细胞是(i)嗜碱性常母细胞,(ii)多色常母细胞,(iii)原色常母细胞,(iv)网织红细胞,(v)带细胞和(vi)中性粒细胞。比例尺−75µm。
传感器通常可以在生物体形态理论的实施中发挥关键作用,将个人的数据生成扩展到目前任何可用的范围之外。一方面,传感器可以是系统固有的。举例来说,类似于脉搏血氧测定,生物体血液中的氧饱和度可以通过不同血红蛋白衍生物的不同光学光谱来测量。此外,脉搏血氧测定法还能提供有关血液搏动特性的定性信息(148)。氧饱和度的测量可以使用小型化传感器进行,也可以使用高光谱成像技术进行空间分辨。氧饱和度的测量提供了关于氧输送能力、氧分布的重要信息,并结合微粒成像测速分析,提供了纳入一个生物体的每个类器官的绝对耗氧率(149)。

图4 |白蛋白和MDR2基因表达从第0天到第14天在由ipsc来源的早期儿肠、肝脏、肾脏和神经类器官组成的4器官芯片中稳步增加,这些模型整合在基于生理学的共同介质循环中。仅通过肠吸收无分化因子的培养基。采用单因素方差分析+ Tukey’s多重比较检验进行统计分析(*p < 0.05, **p < 0.01, ***p < 0.001)。数据显示为Mean + SD。
另一方面,传感器可以直接嵌入到MPS中。多传感器的集成是允许持续在线监测器官特异性反应和动态组织反应的基础,用于人体健康监测的技术(150)。多传感器集成平台对于基于MPS的生物体体的发展尤其重要,在这种生物体中,对各种器官功能的监测需要结合不同的传感原理。跨上皮电阻测量是最受欢迎的非侵入性技术之一,已成功集成到MPS中,以评估内皮或上皮模型的屏障完整性和连接动力学(151)。基于电阻抗谱的方法通过利用扩展的频域数据克服了传统的跨上皮电阻测量技术,因此,可以评估不同成熟阶段的组织屏障功能(152)。当与多电极阵列相结合时,基于阻抗的技术可以进一步增强,从而在生物体的相关微环境中提供局部感知和电刺激。应用包括通过对收缩活动的直接电刺激再现心肌细胞或运动神经元的神经支配(153),以及从神经元产生替代脑电图的可能性活动,这代表了帕金森或阿尔茨海默病建模的附加价值。
器官模型的神经支配在其发育、成熟、调控、再生和病理过程中起着至关重要的作用。我们从器官移植手术中了解到,消除自主神经元连接可能会导致移植物功能低下和不良的影响(154)。同样,神经支配在大多数器官和组织中干细胞和/或其生态位调节中的重要性也得到了充分的证明。在器官发生和再生的初始阶段,自主神经会影响组织的生长,同样,也会影响衰老或疾病的发展和进展。到目前为止,将神经支配引入体外模型大多被忽视,这是由于实现正确的引导和将神经元整合到非神经组织模型的复杂性。在过去的十年中,在静态和MPS类器官培养中,已经采取了第一步来模拟神经模型之间的突触连接和神经和非神经组织模型之间的神经效应器连接形成。这一领域的一个主要挑战是轴突生长从神经元到效应组织的定向引导。因此,MPS的发展使干细胞来源的有髓运动神经元能够组装和培养(155,156),是实现MPS功能神经支配的重要基础。理解组织来源的神经营养因子和神经引导因子如何驱动轴突生长并在发育过程中决定其方向将是有帮助的。
干细胞来源的区域化脑类器官已被证明具有相互形成突触神经的内在能力。多个研究小组已经描述了区域化干细胞来源的皮质类器官和大脑皮层类器官的融合,以模拟GABAergic中间神经元从大脑皮层类器官迁移到谷氨酸兴奋性、富含神经元的皮质类器官,在那里它们在功能上整合到局部兴奋性回路(157-159)。这种内在能力也可以被用于组装其他区域化的脑类器官,正如干细胞来源的皮质和丘脑类器官所显示的那样(159)。
Roger D. Kamm的团队已经证明,干细胞来源的运动神经元类器官可以在一个有图案的芯片平台上用3D骨骼肌束构建功能性神经肌肉连接(nmj),这增强了组织结构的引导神经支配。在这个设置中,运动神经元被转导到光敏通道视紫红质-2,这使得光激活的肌肉收缩显示了功能性神经肌肉接头的形成(160)。另一项关于干细胞来源的类脑器官的研究表明,它们可以发育出明显的轴突束,这些轴突束在功能上被神经支配到啮齿动物的脊髓外植体中,它们在那里引起协调的肌肉收缩,很容易区别于局部自发收缩,并可以通过电刺激诱发(31)。神经支配对心脏组织的成熟和功能的积极影响在(161)中得到了证明,交感神经元的神经支配增加了原代心肌细胞的自发搏动率。
已经制定了一些方案,忽略轴突生长对相应的非神经组织类器官的复杂影响;允许在一个类器官中同时分化神经组织和非神经组织。这已经在含有功能性神经肌肉接头和有髓鞘轴突的神经肌肉类器官中实现了,在许旺末端细胞和肌肉部分收缩活动的存在下,收缩活动在乙酰胆碱受体堵塞时停止(162)。前脑和视神经囊泡的结合也实现了这种器官间球体,其中双侧光敏视神经囊泡发育在前脑类器官的表面,并形成电活性的原始感觉回路(62)。
体外组织神经支配领域的下一个重大进展将是建立一个封闭的神经元回路模型,其中感觉器(如视杯类器官)和效应器(如肌纤维)通过皮质模型相互连接,并通过Schwann细胞或少突胶质细胞实现运动神经元轴突的髓鞘化(156,163)。另一种有前景的方法是结合芯片上的血管化和神经支配。在体内,周围神经沿着血管生长。我们假设,一旦建立了封闭的血管系统,这种神经支配途径也将成为相关的芯片。(116)展示了血管化和神经连接的优势,他们证明了血管-神经相互作用导致更像活体的基因表达特征,并增加含有干细胞来源的大脑微血管内皮细胞和运动神经元的MPS中的钙瞬变。除了(运动)神经元对生理组织神经支配的积极作用,外周神经系统的建模对于神经退行性疾病(如肌萎缩性侧索硬化症)领域也有兴趣。体外(MPS)模型有可能成为研究化合物对神经肌肉接头药理作用的重要基石。这个方向的第一步是最近在Mimetas OrganoPlate上发表的(164),该平台培养了40个带有iPSC衍生的运动神经元的微芯片。后者表现出明显的轴突生长,可以与肌肉组织耦合形成神经肌肉接头。
关于机体内稳态的另一个关键方面是自主神经支配与免疫系统的相互作用。以消化道为例,肠道免疫系统影响局部肠神经系统、交感神经和副交感神经系统的外源性神经元,并最终影响大脑功能,如情绪、认知和心理健康。相反,大脑可以通过肠道胆碱能抗炎通路,通过迷走神经调节肠道的免疫功能(165)。初级淋巴器官(如骨髓)和次级淋巴器官(如脾脏)的神经支配已得到充分研究,神经系统在这些小生境中影响免疫稳态和炎症的能力已被证明(166)。
在芯片上模拟系统有机体通路的另一个重要方面包括整合相关供体特异性微生物群,以模拟患者与各自代谢物的总体相互作用(167-169)。
看来,神经支配、血管化、淋巴管、微生物群和胆汁产物的肠-肝脏循环模拟是满足多器官MPS中类器官的简单物理结合和生物体中真正的组织相互作用和稳态之间的鸿沟不可或缺的先决条件。
后者需要至少10个人类系统(如引言中强调的那样)的主要类器官的串联组合,以及它们通过血管系统、神经支配和淋巴管的生物互联。关于建立包含至少10个技术上可相互连接的器官培养区隔的MPS的两项早期尝试已经发表。这些主要的例子包括康奈尔大学舒勒实验室(Shuler Lab)的13个器官培养系统(170个)和麻省理工学院格里菲斯实验室的10个器官培养PhysioMimix系统(171)。这两种系统都已成功地在培养室中使用生物材料运行了7天或更长时间。然而,两者都缺乏生物血管互连、淋巴管和器官神经支配。
生物体可能会传递什么给我们的医疗系统
根据有机体模型理论,有机体模型是活体人体在体外的生物复制品,只是尽可能缩小了规模。它们是由系统创造的整合:生理学上把人体主要器官的功能单位整合成一个有机的、自我维持的模板,反映人体的系统组织干细胞衍生器官等价物在芯片上的快速分化,源于它们之间的相互串扰和生理上的相互依赖。规模的极端缩小,是由于产生个体的生物体样体的大量重复的目标。大量这种相同的、微小的、无脑的、无情绪的生理体外有机体的成熟可以在很长一段时间内保持自我维持的功能性健康内稳态。它们容易受到干扰,导致自然或人为地诱发疾病。患病的生物体被假设以精确地模拟各自病人疾病的病理生理学。反过来,这可能使预测性的患者特异性有机体样研究的表现,以确定最有效的个性化治疗患者有关。类似于对患者队列的临床研究,然后可以产生统计验证的预测,其优势是可以在生理和病理生理条件下比较基因相同的患者有机体样体重复。由此可以推导出两种主要的使用场景。一种是与现实世界中个体患者个人治疗的前沿改进有关;另一种则有可能在临床试验层面改变药物开发范式,节省大量时间和资本支出。
关于第一种方案,生物体模型可以用于预测地选择、安排和给药,根据患者的疾病进展准确地选择个性化治疗或药物。通过早期发现不成功的治疗方案,这可以显著降低对每个患者的潜在风险。图5更详细地总结了将有机体应用于个性化精准医疗的优势。该图说明了有机体体方法的概念和原理,以选择最适合您的个性化疾病应用的精准医疗。作为一个假设的例子,癌症被选择为疾病。
你的生命周期可能最终包括危及生命的疾病时期,例如,癌症生长(上:蓝色边框的箭头)。从你的健康细胞中建立一个多能干细胞库。随后,在几个月内就会产生大量相同的健康生物体(黄色三角形)。目前有各种治疗癌症的选择,因此,相关的试验组被创建,包括安慰剂治疗、其他治疗组和健康恢复对照组(在黑边箭头中)。在这个假设的例子中,在几周内,CAR-T细胞疗法与检查点抑制剂相结合,会被证明是你最快最有效的治愈方法。因此,这种疗法立即得到了成功的应用。
根据生物体形态理论,一个人的干细胞库可以在健康时创建,也可以在疾病发生时从健康的器官中创建。预防性干细胞库(例如,从脐带血中提取)已经在使用中,并将成为未来的选择,因为这需要时间。接近人类的理论提供了精确的试验结果,这是动物试验在患者来源的异种移植模型或人类患者来源的类器官无法实现的。异种移植模型在系统发育上是遥远的,因此不能提供足够的肿瘤生长。此外,它们没有病人的免疫背景来对抗癌症。病人来源的类器官也没有嵌入到病人的免疫系统中,缺乏与有机体的系统性互动。
对于第二种情况,数十年来,候选药物进入临床试验成为获批药物的平均成功率一直低于20%;这种将任何原型转化为上市产品的低效率,其他任何行业都承受不起。使用实验动物的候选药物的临床前安全性和疗效评估程序的预测性差是造成这种低效率的主要原因。其后果是平均13.5年的漫长临床试验,以及一种新药获得批准所需的累计成本高达25亿美元(106)。与此同时,在过去30年里,一场基于生物学的治疗策略革命出现了——利用人体自身的工具来对抗疾病。近年来,药物的生物复杂性不断扩大,从人工合成的小分子药物,到人类单克隆抗体蛋白,最后是针对患者的自体细胞疗法,极大地增加了患者治愈的机会。然而,这一趋势同样显著地降低了通过应用临床前的实验室动物试验来预测这类疗法的安全性和有效性的机会,原因是这类先进治疗药物的人类起源越来越多(172)。此外,在过去的几年里,沿着这种不断上升的生物梯度的药物定价已经成为阻碍所有患者获得这种疗法的社会公平的主要障碍。在这一趋势开始的时候,一种生物药物的平均日剂量的价格是小分子药物的22倍,占几十美元(173)。然而,类蛋白质生物制剂中最好的单克隆抗体在2017年达到了患者治疗过程的年平均价格约为9.6万美元(174),相当于每天约263美元。如今,先进细胞疗法中最具颠覆性的创新——高效的自体CAR-T细胞疗法——在德国的价格,例如,考虑到“在”结果(175)付款,患者治疗的价格高达32万欧元。这种疗法是一天输注一次。药物的疗效与患者获得药物的经济能力之间日益增长的失衡,已经成为全球范围内我们的医疗保健系统的一个严重的社会和经济冲突。
有机体有可能通过改变药物开发的模式来打破这种成本螺旋上升。2016年,MPS相关报告已经预计,一旦基于MPS的类似于生物体的临床试验研究能够准确预测任何新药物或疗法的疗效、安全性、剂量和时间安排,在用于人类试验和替代动物试验以及1、2期临床试验之前,累积药物开发成本将降低5倍,药物开发时间将减少一半。
2018年,毒理学研究领导人论坛(10)草拟了一份高级路线图,以确定“临床试验”预测精度(图6),在与临床试验相对应的芯片研究中运行精细的个性化的“人体”等效物(有机体)。为了实现这一点,套健康的和有病的代表患者疾病状态和健康内稳态的有机体样体将允许一个人进行基于临床前系列药物和先进的有机体样体测试。

图5 |说明有机体理论如何应用于个性化医疗的假设例子。
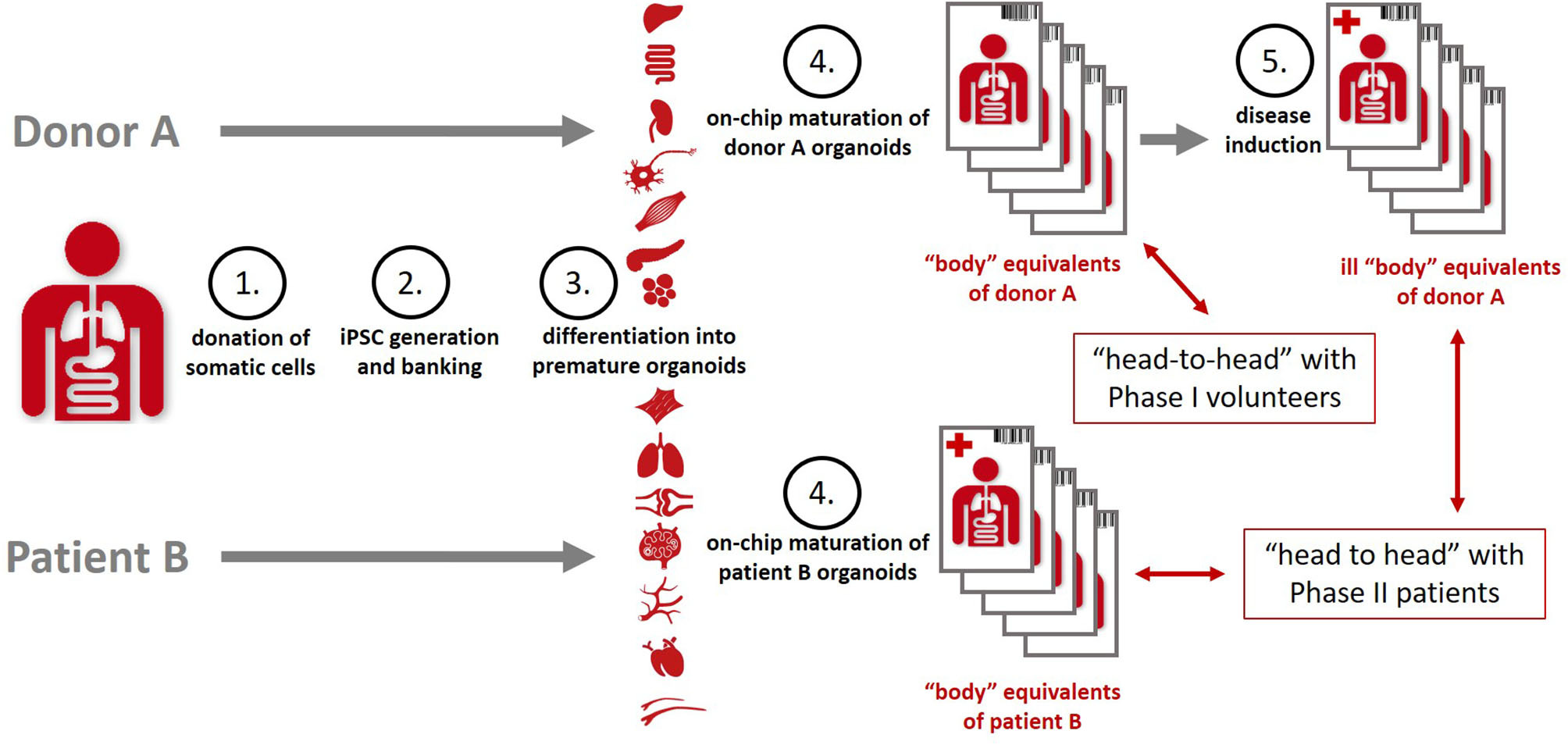
图6 |在芯片上潜在的“临床试验”背景下的“人体”等效物(10)。

图7 |一个假设的例子,说明有机体理论如何可以用来模拟临床试验。
健康的内稳态将允许一个人在大型试验特定患者中模拟临床试验的环境中进行基于有机体的药物和先进疗法的临床前系列试验。与患者队列试验相比,以有机体为基础的试验具有许多关键的优势。图7详细说明了这些优势,并举例说明了利用基于有机体的试验模拟一种假想的新型钠-葡萄糖转运体2(SGLT2)抑制剂治疗2型糖尿病的临床试验。
根据与临床试验招募相同的标准,从全球干细胞库中收集代表相关糖尿病患者队列的4名捐赠者的干细胞样本。从这4个供体小瓶中每个小瓶生产出相关数量的健康生物样体。蓝色、棕色、黄色和绿色表示每个个体的供体背景。随后,遵循生物样体理论的原则,例如通过高糖饮食产生糖尿病生物样体。为了评估一种新的SGLT2抑制剂治疗,进行了3个月的试验,包括6个组,每个组12个有机体样体(每个组和供体3个生物重复),并每天口服相应的药物。对照组包括健康恢复组(1)和患病未经治疗的安慰剂组(2),分别提供治愈(绿色基线)和疾病状态无变化(红色基线)的读数。此外,三种新的SGLT2抑制剂的剂量降低了10万倍。由于与人体相比,生物体的大小相对较小,因此患者的剂量比预期的要低。臂(3)、臂(4)和臂(5)的读数说明了新的单药疗法在分别对应于每天和患者的25 mg(黄色方块)、15 mg(黄色三角形)和5 mg(黄色圆圈)的剂量下,将疾病状态从基线改变为治愈的潜力。假设使用二甲双胍(蓝色圆圈)治疗的标准单药治疗组提供了当前标准的护理参考数据。在这个假设的例子中,臂(2)产生了最有利的治疗结果。
最突出的优势是,在药物开发历史上,基于芯片的有机体试验将首次包括患者身体和同一个体健康身体状态的统计相关的人体自体生物重复。由于缺乏对单个患者的任何生物重复,以及对他们在健康内稳态下的个体生物状态的了解,临床试验传统上需要大量的患者队列。因此,试验被分为1、2和3期,不幸的是,只能近似一个患者个体的病理生物学和他们的完全治愈恢复状态。这两个方面使得传统的临床试验过程成为一种漫长的、成本高得令人难以置信的、低效的药物和先进疗法的开发方式。在含有健康和患病生物体的芯片上进行“临床试验”,消除了这两个障碍。一方面,它们允许近亲繁殖的实验室动物试验的一致性由于基因而得到匹配,每个试验“参与者”在个体有机体水平上的身份,但其背景完全是人类。另一方面,各种不同个体的生物样体的使用反映了临床试验中患者队列的异质性,但具有每个个体患者的生物样体在统计上相关的生物重复的优势。
有机体体方法的另一个明显优势是,在进行此类试验时,其独立性不受患者招募和医院使用的影响。鉴于大型PSC库的存在反映了基因倾向、性别和与试验相关的其他类别,基于有机体模型的试验可以在世界任何时间、任何地点进行。关于上面的假设例子,根据糖尿病易感性选择供体,比较遗传祖先和平等的性别分布可能是有趣的干细胞瓶选择策略。
第三个优点是试验规模的灵活性。理论上可以产生的患病生物体(通常被称为芯片上的“病人”)的数量是无限的。这使得药代动力学方面的整合,在同一个基于有机体的试验中发现新的化学或生物实体的有效剂量和综合安全性和有效性评估成为可能。目前在实验室动物、健康志愿者和患者的单独临床前和临床试验中产生的数据,如毒性特征、未观察到的副作用水平、吸收和排泄率、代谢物形成、发现有效剂量、持续时间和新药物的时间安排,可以从一项基于生物体的试验中得到。例如,我们治疗2型糖尿病的假设案例研究可以很容易地扩展到更大的剂量范围,并将每天两次剂量的单一口服(这在生物样体中指的是根尖肠的任何给药)进行比较。这将包括对疗效进行剂量依赖的评估,同时观察尿路或生殖道感染的发生和严重程度,以及众所周知的SGLT2抑制剂的副作用。在各自的患者队列中,候选药物使用的治疗窗口的定义来源于这样一项一体化试验,该试验仍处于临床前候选药物开发阶段。
关于这两种使用场景,我们设想有机体将对从个人数据库收集的医疗现实世界大数据做出重大贡献。这是因为它能够在每个患者第一次疾病发作(例如,肿瘤生长、病毒复制)的确定位置生成关于微环境破坏的独特可复制数据。有机体和硅芯片的结合将进一步提高对大量患者群体进行精确药物治疗的预测能力,并进一步降低成本。
在人们的心目中,复杂的体外细胞培养工作通常与高昂的成本联系在一起。有人可能会猜测,在试验中产生和处理数千个生物体需要天文数字的预算,因为目前可用的MPS在一次性芯片和操作上都很昂贵。在这里,有机体的性质反映了一种自我可持续的人体和规模经济效应开始发挥作用。在现实世界中,一个处于休息状态的人体,每天的蛋白质、碳水化合物和脂肪供应约2000千卡就可以维持。在世界上一些较贫穷的地区,人均几美元就可以实现这一目标。因此,每天喂养10万只生物体的成本也可以达到相同的水平。维持这些生物体的可消耗芯片的价格也预计将下降到1美元的范围,这在计算机芯片和人类基因组测序成本方面已经有过先例。
生物机体能够为每一位患者确定最合适的药物,并大幅节约成本和改变药物开发,这种能力的社会经济维度被认为是巨大的。这同样适用于伦理层面。基于MPS的类有机体有可能取代大多数实验室动物试验和在人类志愿者身上进行的第一和第二阶段临床试验。它们将减少三期临床试验患者的多种数量。所有这些都将对全球范围内的患者利益和动物福利产生根本性的积极影响。
患者类有机体体和芯片上病人特异性T细胞疗法——一个挑战这一理论的完美方案
先进的细胞疗法,如自体嵌合抗原受体(CAR) T细胞疗法KymriahTM 和YescartaTM,最近已经证明了它们治愈以前的耐药肿瘤患者的潜力(176,177)。除了这两种在2017年被批准用于治疗血液肿瘤的CART细胞产品外,其他几种CAR-T细胞产品最近也被批准。许多新的细胞治疗方法正在酝酿中,使用CAR或转基因T细胞受体对抗各种各样的肿瘤、感染和自侵略性免疫细胞,或者使用调节性T细胞在显性的不良免疫反应中恢复免疫平衡(178)。到2020年底,全球注册了超过1000项使用免疫细胞产品的临床试验(179)。
在这些医疗需求未得到满足的领域,这种前所未有的疗效以标准安全测试程序(180)为代价,增加了监管机构的接受度,该程序需要在治疗批准后的患者随访研究中进行回顾性研究。这符合这样一个事实,即由于患者与患者的系统发育距离、各自的基因型差异和免疫不匹配,患者对个性化细胞治疗的反应无法在临床前的实验室动物模型中模拟。同样,在传统的患者来源的类器官培养中,患者的反应也无法预测,因为它们没有融入到一个系统的有机体安排中。除其他外,模拟t细胞输注到目标部位的静脉输送及其与其他主要器官部位的相互作用,都缺失了模拟T细胞疗法及其疗效(患者衍生类器官的精确度)的关键因素。 如前所述,这里的有机体理论提供了一种克服任何其他障碍的替代解决方案。
什么是有机体不能也不应该做的
根据有机体理论,有机体不能也不应该模仿人类个体社会起源的主要部分——同理心或意识(分别是灵魂或思想)。因此,它不能模拟病人的精神疾病。300g的人类心肌或髋部骨折的功能障碍及其愈合依赖于生物物理特性,由于规模和所涉及的物理不匹配,其中一些无法在生物类体上表征。
伦理考量对人类社会至关重要,也是人性的基础。有机体理论,由于其性质,引入了一些必须考虑伦理的观点。将人类胚胎发育到几厘米大小是最关键的问题之一。在人工环境下(如体外培养),人类卵子的受精及其随后的胚胎发育在世界上许多地方都是被禁止的。生物体理论的作者想要强调的是,他们的伦理范式超越了这一点。人们不应该使用有机体形态理论的概念和原则来创造人类或杂交胚胎,并进一步发展和区分人类或杂交组织。应该使用其他方法来规避个体发生的这一部分。个人同意捐献组织来创造生物体可能是一个很好的工具,以防止在早期阶段的滥用。
结论
这里提出的生物体样体理论声称,有能力在体外人工重现个体身体的个体发生,从捐赠者的干细胞开始,产生一定数量的相同的健康成熟的小型化身体等量物,因此被称为生物体样体。该理论进一步声称,这种供体特定的相同生物体样体反映了该个体健康成年期的某个阶段,可以用来模拟该供体在其生命周期的某一特定时间内相关的疾病和康复阶段。以个性化的患病生物体样方法对个体的疾病进行建模,将提供一个尚未满足的患者病理生物学的现实水平,因此,提供一个前所未有的工具,以精确选择正确的药物、治疗计划和剂量来治愈(患病)个体。
大自然的遗传和微环境原则编码了人体器官最小功能单元的自组织和维护,并将它们整合到一个交流通讯和高效互动的血液系统中,灌注和神经器官是在芯片上创造生物体的蓝图。我们设想它们将成为下一个层次的人类生物学模拟,提供与人类相对应的最佳可能的近似。在体外实验中,类有机体organismoids将有机地遵循人类的多个类器官串联,近年来,这已被证明能够在小型化的规模上模拟单个组织和器官的不同功能。利用已从类器官学习到的东西,类器官将通过一个小型化的基于生理的血管和毛细血管网络在芯片上生成的全血的系统神经支配和供应,以每个器官的功能单元。通过内皮细胞层将每个类器官从共同的血液中局部分离,将使不同人体器官功能单元的精确拷贝在芯片上实现单独的器官特异性、遗传编码和微环境驱动的自我组装。反过来,这将使成熟的类器官在生理上产生交流,从而导致有机芯片上的内稳态。一旦建立,生物体将只需要每天用消化的食物等量进食,就可以模拟芯片上的长期、所谓的自我维持的身体功能。
我们已经说明,类器官体外培养技术和过去10年生产的单器官芯片为体外类器官的培养提供了大量数据。此外,人类iPSC衍生的多器官串联芯片提供了芯片上加速人工器官个体发生的第一个成果。最后,越来越多的关于人类疾病建模和人体组织芯片治疗测试的科学文献指出,当MPS上完全功能性地建立多器官串联芯片以及人体芯片时,这种微生理平台就有能力精确模拟疾病的病理生物学和药物或治疗的作用模式。进一步发展器官芯片的主要挑战是神经支配和类器官毛细血管化的实现,这也需要细胞,特别是免疫细胞迁移到组织中。
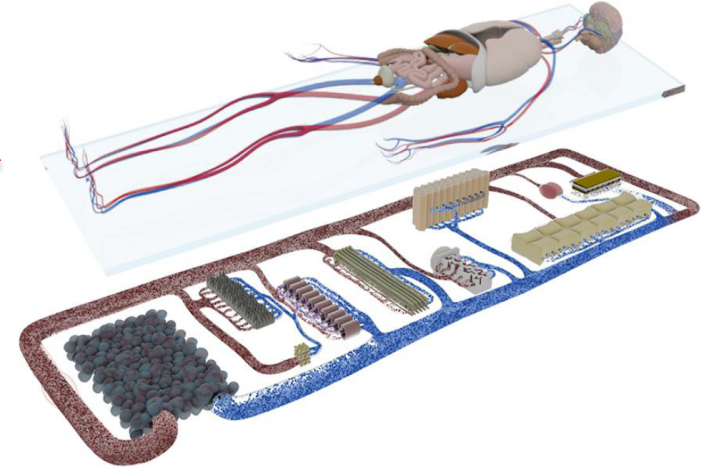
类器官串联芯片培养系统--- HUMIMIC
多器官串联培养,在没有病人的情况下测试病人
类器官串联芯片培养系统包括控制单元和芯片,控制单元能够模拟人体内生理环境,包括温度、压力、真空度、微流道循环频率、时间等参数,芯片有不同的微流道设计,针对不同的器官可以单独设置提供相应的培养条件,提供精准的培养和分化环境。类器官串联芯片培养系统可提供不同类器官的串联共培养方案,避免单一类器官无法模拟人体复杂生理学条件下器官相互通讯交流的不足。通过类器官模拟人类器官组织的生理发育过程,应用于疾病模型、肿瘤发生、以及药物安全性、有效性、毒性、ADME等方面的评估,旨在减少和取代实验室动物测试,简化人体临床试验。
为获取更高相关与准确的测试结果,我们开发了人体器官模型的自动芯片测试:
配备具有指示相关性的器官模型的芯片,以能够在接触生物体之前检测其安全性和有效性;
最终为芯片配备患者自身相关病变器官的亚基,以评估整个个性化治疗的效果;
人体生理反应往往涉及更多介质循环和不同组织间相互作用,多器官芯片才能全面反映出机体器官功能的复杂性、完整性以及功能变化,一个相互作用的系统才能更好的模拟整个系统中器官和组织的不同功能。德国TissUse公司可提供不同类器官的串联培养解决方案,避免单一类器官无法模拟人体复杂生理学条件下器官相互通讯交流的不足。把多种不同器官和组织培养在芯片上,然后通过微通道连接起来,集成一个相互作用的系统,从而模拟人体中的不同功能器官的交流通讯和互相作用。
TissUse专有的商用MOC技术支持的器官培养物的数量范围从单个器官培养到支持复杂器官相互作用研究的器官数量,包括单器官、二器官、三器官和四器官培养的商业化的平台。成功的案例包括:肝脏、肠、皮肤、血管系统、神经组织、心脏组织、软骨、胰腺、肾脏、毛囊、肺组织、脂肪组织、肿瘤模型和骨髓以及各自的多器官串联组合方案。
德国TissUse公司专注于类器官培养系统研究22年,推出的HUMIMIC类器官串联芯片培养系统,得到FDA的推荐,可提供不同类器官的串联培养解决方案,避免单一类器官培养无法模拟人体器官相互通讯关联的缺陷,同时也提供相关的技术方案和后续方法试剂支持,属于国际上少有的“Multi-Organ-Chip” 和“Human-on-a-chip”的方案提供者。相关方案已被广泛应用于药物开发、化妆品、食品与营养和消费产品等多个领域.
参考文献
1. Marx, U.; Walles, H.; Hoffmann, S.; Lindner, G.; Horland, R.; Sonntag, F.; Klotzbach, U.; Sakharov, D.; Tonevitsky, A.; Lauster, R. ‘Human-on-a-chip’ Developments: A Translational Cutting-edge Alternative to Systemic Safety Assessment and Efficiency Evaluation of Substances in Laboratory Animals and Man? Atla-Altern. Lab. Anim. 2012, 40, 235–257. [CrossRef] [PubMed]
2. Almeida, A.; Sarmento, B.; Rodrigues, F. Insights on in vitro models for safety and toxicity assessment of cosmetic ingredients. Int. J. Pharmaceut. 2017, 519, 178–185. [CrossRef] [PubMed]
3. Mehling, A.; Eriksson, T.; Eltze, T.; Kolle, S.; Ramirez, T.; Teubner, W.; van Ravenzwaay, B.; Landsiedel, R. Non-animal test methods for predicting skin sensitization potentials. Arch. Toxicol. 2012, 86, 1273–1295. [CrossRef] [PubMed]
4. Petrova, A.; Capalbo, A.; Jacquet, L.; Hazelwood-Smith, S.; Dafou, D.; Hobbs, C.; Arno, M.; Farcomeni, A.; Devito, L.; Badraiq, H.; et al. Induced Pluripotent Stem Cell Differentiation and Three-Dimensional Tissue Formation Attenuate Clonal Epigenetic Differences in Trichohyalin. Stem. Cells Dev. 2016, 25, 1366–1375. [CrossRef]
5. Mertsching, H.; Weimer, M.; Kersen, S.; Brunner, H. Human skin equivalent as an alternative to animal testing. GMS Hyg. Infect. Contr. 2008, 3, Doc11.
6. Maruguchi, T.; Maruguchi, Y.; Suzuki, S.; Matsuda, K.; Toda, K.I.; Isshiki, N. A New Skin Equivalent—Keratinocytes Proliferated and Differentiated on Collagen Sponge Containing Fibroblasts. Plast. Reconstr. Surg. 1994, 93, 537–544. [CrossRef]
7. Stark, H.J.; Baur, M.; Breitkreutz, D.; Mirancea, N.; Fusenig, N.E. Organotypic keratinocyte cocultures in defined medium with regular epidermal morphogenesis and differentiation. J. Investig. Dermatol. 1999, 112, 681–691. [CrossRef]
8. Reijnders, C.M.A.; van Lier, A.; Roffel, S.; Kramer, D.; Scheper, R.J.; Gibbs, S. Development of a Full-Thickness Human Skin Equivalent In Vitro Model Derived from TERT-Immortalized Keratinocytes and Fibroblasts. Tissue Eng. Part A 2015, 21, 2448–2459.
北京佰司特科技有限责任公司 (https://www.best-sciences.com)
类器官串联芯片培养仪-HUMIMIC;灌流式细胞组织类器官代谢分析仪-IMOLA;类器官光片显微镜-LSM-200;
蛋白稳定性分析仪-PSA-16;单分子质量光度计-TwoMP;超高速视频级原子力显微镜-HS-AFM;
全自动半导体式细胞计数仪-SOL COUNT;农药残留定量检测仪—BST-100;台式原子力显微镜-ACST-AFM;微纳加工点印仪-NLP2000DPN5000;
- 2024-11-10
- 2024-11-10
- 2024-11-10
- 2024-11-10
- 2024-11-09
- 2024-11-05
- 2024-11-04
- 2024-10-24
- 2024-10-24
- 2024-10-20
- 2024-10-17
- 2024-10-13
- 2024-09-19
- 2024-09-15
- 2024-09-12
