行业动态:关于类器官药敏测试的专家共识发表
行业动态:关于类器官药敏测试的专家共识发表
翻译整理:北京佰司特科技有限责任公司
近年来,类器官技术在癌症研究和治疗中展现出了巨大的潜力。作为癌症精准医疗和药物开发的新利器,类器官药敏检测(Drug Sensitivity Testing, DST)得到了广泛关注和认可。2024年5月27日,国内多位科研院所及医院的专家联合发表的首篇类器官药敏检测英文专家共识——《Building consensus on the application of organoid-based drug sensitivity testing in cancer precision medicine and drug development》,在国际顶.尖期刊《Theranostics》上正式发表。这篇共识不仅重新定义了基于患者衍生类器官(Patient-Derived Organoids, PDOs)的药物敏感性测试,还为标准化PDOs药物敏感性测试提供了首.个指导原则,填补了类器官药敏检测领域专家共识的空白。
文章题目
Building consensus on the application of organoid-based drug sensitivity testing in cancer precision medicine and drug development
杂志:《Theranostics》(IF=12.4)
发表时间:2024年5月27日
作者:陈晔光(清华大学、南昌大学基础医学院),高绍荣(同济大学)、刘连新(中国科学技术大学附属第一医院)、刘颖斌教授、向冬喜教授(上海市肿瘤研究所、上海交通大学医学院附属仁济医院)
1、肿瘤类器官及应用场景
肿瘤类器官是具有三维(3D)结构的体外培养模型,由具有干细胞特征的细胞自我分化而来,可长期扩增并重现肿瘤组织中复杂的细胞异质性和空间结构,保留病理组织学特征和一些遗传特征等。PDOs是器官或组织的微型简化版本,可通过构建疾病模型、搭建生物样本库、模拟肿瘤微环境、药物发现、精准医疗和基因编辑等,为肿瘤研究和药物发现提供有价值的平台。
肿瘤类器官的应用场景主要包括:
1. 构建能够再现原发肿瘤组织的体外模型:PDOs通过采集不同来源的肿瘤样本培养而成,包括原发性肿瘤、循环肿瘤细胞和转移病灶等。在机械和/或酶消化的作用下对组织进行预处理,肿瘤细胞最终在基质中生长成为三维肿瘤PDOs。PDOs内有多种异质细胞,每种细胞在复杂的癌症发生和发展过程中都扮演着独特的角色。
2. 建立活体PDOs类器官生物样本库:PDOs可长期扩增、冷冻保藏和复苏,在活跃增殖阶段进行冷冻保藏,可提高其复苏效率。将PDOs置于含有冷冻溶液的冷冻管中,冰上放置30分钟后在-80°C下冷冻保存过夜,并转移到液氮中长期储存。PDOs复苏时,可在37°C下快速解冻,再置于培养皿中进一步操作。冷冻/解冻单细胞悬液或大型且分化的类器官时如操作不当,可能会导致复苏不良、形态变化或对药物筛选结果产生潜在影响。因此,应遵循与细胞系类似的冷冻/解冻原则,且PDOs应在复苏后的1-2周内恢复其扩增能力。
3. 体外肿瘤模型提供了一种极具价值的标准化实验平台,使研究人员能够调整诸如营养供应、氧气水平和药物处理等变量,进而探究它们如何影响肿瘤细胞行为。
4. PDOs可以预测不同类型癌症患者的临床反应,如结直肠癌、乳腺癌、肺癌、卵巢癌、尿路上皮癌、胃肠道肿瘤和胰腺癌等,也可以进行前瞻性治疗评估,从而推进肿瘤精准医疗。通过培养PDOs筛选潜在最有效的治疗方案,通过优化治疗方案和减少不必要的副作用,为改善患者预后提供了可能。
5. 通过基因编辑技术对肿瘤驱动基因进行编辑,可以开发出基因修饰的肿瘤类器官模型,从而研究肿瘤基因突变的发育机制,并用于肿瘤生物学研究、耐药机制探索和癌症治疗新方法的开发。

图1为类器官模型广泛的应用前景
2、专家共识及解读
• 专家共识1:PDOs在临床前研究中具有广阔的应用前景,可用于新治疗靶点的发现和验证、药效学评价、实时诊断生物标志物的检测、药物适应症的拓展、药物作用、耐药机制的探索以及体内药代动力学等方面。
解读:在临床前研究中,PDOs作为一种高效的“患者替身”,能够精准复现来源肿瘤组织的复杂细胞结构和功能,为探索疾病机制,阐明分子途径以及探索治疗干预提供了一个卓越的实验平台。随着对不同组织来源的类器官进行建模,它们在多组学分析和基因编辑研究中的应用变得日益重要,特别是临床前药物开发阶段,在识别新的药物靶点方面发挥着至关重要的作用(图2)。
PDOs模拟了来源肿瘤组织的生物学特征,从而为制定匹配的个性化治疗策略提供了支持。目前报道的肿瘤类器官模型覆盖了食管癌、肺癌、乳腺癌、胃癌、肾癌、结直肠癌和肝癌等多个癌种。同时,PDOs作为有效的临床前药物研发模型,被广泛应用于发现新的药物靶点、测试药物剂量、探索诊断生物标志物、重新利用现有药物,并构建PDO-异种移植(PDOX)模型等。

图2为肿瘤类器官模型在精准医疗和药物发现中的应用
• 专家共识2:药物的临床前研究在很大程度上依赖于稳健的模型。PDOs非常适用于研究罕见的恶性肿瘤、无可用模型的肿瘤和耐药肿瘤。
解读:对那些缺乏有效临床前研究模型的疾病,肿瘤PDOs模型可作为一种重要的替代方案(图2),如肿瘤PDOs模型特别适用于研究罕见肿瘤;肿瘤PDOs模型包含了传统细胞系模型所不具备的新型治疗靶点;耐药肿瘤类器官等。通过解析肿瘤细胞间相互作用、以及肿瘤细胞与周围的细胞外基质(ECM)相互作用,有助于研究影响肿瘤行为、免疫反应和耐药性的关键表型与机制。这种生理相关性提供了对肿瘤生物学的更全面理解,使探索新的治疗靶点和治疗方法成为可能。
• 专家共识3:临床试验表明,PDO-DST的结果与患者的实际临床结果密切一致。将PDO-DST整合到临床研究中可以作为临床治疗反应的预测性生物标志物。
解读:通过构建与患者相匹配的类器官模型,研究人员能够测试并分析这些模型对不同治疗方案的响应情况,进而确定出针对特定患者的最佳治疗策略。类器官在癌症治疗领域的主要应用场景包括:
1. 新辅助治疗:对局部晚期癌症患者进行前瞻性和干预性临床研究,筛选肿瘤治疗选择方案并预测新辅助治疗的潜在受益者。
2. 挽救性治疗:对复发风险高或已复发的患者,进行前瞻性和干预性临床研究,旨在识别潜在的治疗受益者。
3. 姑息治疗:对无手术指征的恶性肿瘤复发、转移以及一线或二线治疗失败的患者进行前瞻性和干预性临床研究,以评估精准治疗的潜在受益者。
• 专家共识4:类器官药物敏感性检测已开始应用于临床服务领域;经认可的机构被鼓励进一步优化实验室自建开发测试(LDT)的流程。
解读:如何探索类器官药物敏感性检测的LDT模式?在临床实验室自建检测方法(LDTs)中,对基于患者来源组织构建的类器官进行药物敏感性检测的研究与应用是一个不断发展的领域。
这项测试旨在评估类器官对不同药物或治疗方案的反应和敏感性。目前已经成功在体外构建了多种实体瘤的类器官药物敏感性检测模型,涵盖了乳腺癌、膀胱癌、胃癌和直肠癌等多种癌症类型,这些模型证实了实验室中药物敏感性测试的结果与实际临床治疗效果之间的高度一致性,并为研究肿瘤对药物的敏感性和耐药性提供了强有力的工具。

尽管还需要更多的研究来验证类器官药物敏感性检测是否能够提高患者的无病生存期和总生存期,但为了患者临床获益,鼓励医疗机构将这一创新平台整合到其临床实验室自建开发的测试(LDTs)中,将使医疗工作者能够基于患者肿瘤的具体生物学特性,为患者量身定制更为精准的治疗方案,进而显著提升治疗效果(图3)。
类器官模型用于药物敏感性检测的过程可分为:
1. 样本获取:原发/转移性肿瘤、活检、体液和患者衍生异种移植(PDX)样本等;
2. 药物筛选:包括样本运输、类器官培养、药物筛选和数据分析;
3. 临床治疗:为接受化疗、放疗、靶向治疗、免疫治疗和联合治疗等治疗方案的患者提供治疗选择。

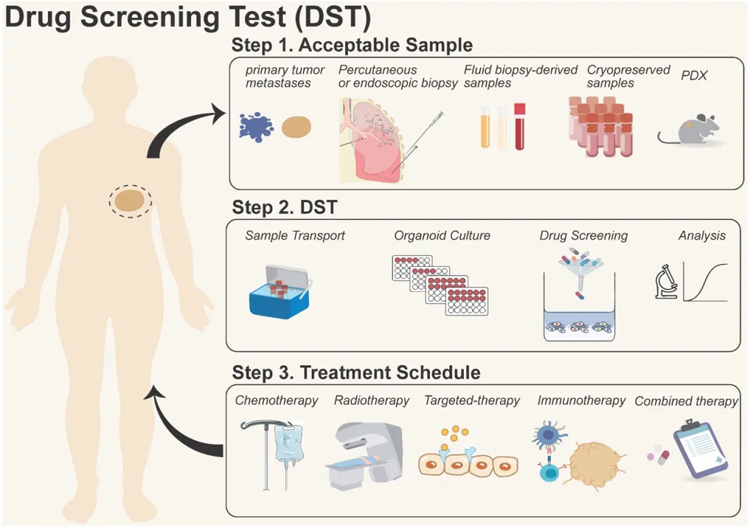 图3为类器官模型用于药物敏感性检测的过程
图3为类器官模型用于药物敏感性检测的过程
在将PDOs-DST纳入临床LDT时要考虑以下几点:
1. 在临床LDT中实施PDOs-DST需严格的验证、标准化和监管审批,以确保其准确性、可重复性和临床实用性;
2. 涉及到在各种监管框架中找到合适的空间与方向,并满足严格的标准,以确保患者的安全性和检测结果的可靠性;
3. LDT领域在不断发展,在临床LDT中探索PDOs-DST的决策取决于多种因素,包括科学证据、监管方面的考虑及医疗界的需求和优先事项等;
4. 对PDOs-DST及其纳入临床LDT的最新状态和潜在未来发展的最准确与最新的信息,建议调研科学文献、咨询监管机构以及该领域的专业医疗专家。
• 专家共识5:PDO-DST和二代测序都属于精准医学领域。然而,PDO-DST具有更高级的应用场景,如新辅助和/或姑息性化疗、一线治疗无效、晚期和罕见癌症、转移性肿瘤等,可以贯穿整个癌症治疗过程。
解读:哪些患者将从类器官药物敏感性检测中获益?在癌症的临床治疗中,分子标记物的识别和审慎应用扮演着举足轻重的角色。然而,真正从基于NGS的精准医疗中获益的患者比例并不高,不到7%,这一现状凸显了癌症治疗中的挑战和复杂性。
然而,Vlachogiannis在2018年报告称,类器官药物敏感性检测在晚期胃肠肿瘤的治疗中展现出了显著的优势。该检测不仅实现了100%的阴性预测,而且阳性预测也高达88%,为PDOs的临床应用奠定了坚实的基础。类器官药物敏感性检测可以为患者对特定药物或治疗方案的反应提供有价值的参考,从而指导治疗决策并改善患者预后。
类器官药物敏感性检测可能获益的人群包括:1) 实体肿瘤患者;2) 接受新辅助化疗的患者;3) 考虑靶向治疗的患者;4) 患有罕见或难治性肿瘤的患者;5) 初始治疗失败的患者;6) 复发或转移性肿瘤患者;7) 对放疗耐药的肿瘤患者;8) 晚期癌症患者;9) 治疗选择有限的患者
• 专家共识6:对于PDO-DST,通过穿刺或胃肠内镜获得的小手术活检样本可以作为癌组织的来源。类器官培养的成功取决于诸如起始组织样本中细胞的活力和质量等因素,以及用于类器官生成的具体方案和培养条件。研究人员和临床医生在为他们的研究或临床应用选择最合适的样本类型时需要考虑这些因素。
解读:哪些类型的样本适用于类器官培养?PDOs可根据具体的研究或临床目标使用不同类型的样本培养构建。不同样本类型对PDOs培养的适用性可能因相关器官、可及性和组织完整性的保存等因素而异,获取高质量的样本是类器官成功构建的关键环节。在避免使用坏死、受损或纤维化组织的同时,采集更多的肿瘤细胞,成功率会更高。
适用于类器官培养的主要样本类型包括:1)外科手术切除的新鲜样本;2)经皮或内窥镜活检样本;3)液体活检样本;4)冷冻保存的样本;5)患者来源的异种移植(PDX)样本。
• 专家共识7:PDO-DST可用于预测个体患者化疗、放疗、靶向治疗和免疫治疗的疗效。
解读:类器官药物敏感性检测能够对哪些治疗策略进行评估?主要治疗策略包括:
1. 化疗:化疗是目前治疗实体瘤的主要方法,也是PDOs-DST的主要应用方向,包括单药和药物联合治疗。PDOs-DST与患者临床响应之间的相关性已经得到了广泛的报道。
2. 放疗:与化疗相似,包括单独放疗和与其它药物联用的组合治疗。
3. 靶向治疗:靶向治疗在大多数实体瘤治疗中尚未得到充分利用,但肺部和乳腺恶性肿瘤除外。对临床诊断和治疗建议,PDOs-DST、组织学标记与大规模、高通量基因突变筛查可能会成为常规手段。
4. 免疫治疗:免疫疗法作为一种癌症治疗手段,展现出了巨大的潜力和应用前景。然而,还需进一步的研究来探索如何利用类器官药物敏感性检测来预测其在临床上的效果,包括:如何在体外维持免疫微环境、如何将类器官与免疫细胞共培养、如何在类器官模型中评估免疫检查点抑制剂(ICIs)的疗效,以及免疫与化疗联合疗法的疗效、如何在体外试验中评估适应性细胞疗法(如CAR-T和TILs)的疗效等。
5. 联合疗法:PDOs-DST可以帮助优化联合疗法。通过检测PDOs对各种药物组合的响应,临床医生可以确认增强治疗效果的协同或叠加效应,有助于设计个性化的联合疗法策略,有可能提高响应率并克服药物耐药性。
特别是,PDOs-DST可用于优化现有的免疫与联合疗法,以及评价新型的联合手段。在临床上,免疫疗法正在越来越多地与化疗、放疗和靶向疗法相结合。目前已经有各种多中心、前瞻性和大规模的联合疗法临床研究,这些临床试验的结果将通过PDOs模型进行验证。
• 专家共识8:为进一步推动PDO-DST及其临床应用,需要研究人员、临床医生、监管机构和医疗保健利益相关者之间的合作努力。时效性是PDO-DST临床应用需考虑的因素,可能的话,在1到3周内产生报告,并且必须通过技术发展逐步缩短PDO-DST所需的时间。持续的研发、验证研究、技术进步和建立共识的努力对于克服这些局限性和发挥精准医学中PDO-DST的全部潜力至关重要。
解读:类器官药物敏感性检测在临床应用前需要克服哪些关键问题和挑战?在将类器官药物敏感性检测转化为临床实践的过程中,遇到了一些关键性的障碍和限制条件,这些问题需要被有效解决以便推动其更广泛的应用。
值得关注和解决的关键挑战包括(图4):样本获取和处理;流程标准化;建模和检测周期;肿瘤类器官构建的成功率;模拟肿瘤微环境;培养基的优化;用于测试的药物浓度的确定;类器官药敏敏感性测试的质量控制;验证以及确认药敏结果与临床结果的相关性;监管标准;时间和成本的考虑等。

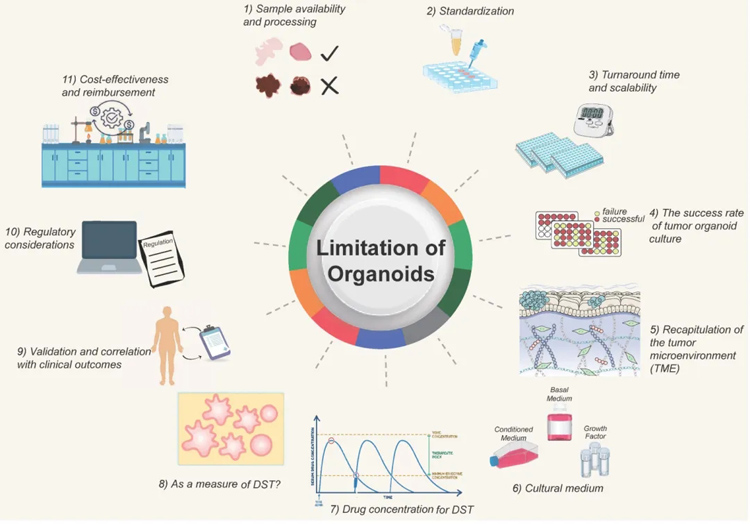 图4为类器官模型的挑战和发展方向
图4为类器官模型的挑战和发展方向
3、研究结论
PDOs在临床前研究中具有广泛的应用前景,该共识提出了PDOs-DST在肿瘤精准医疗和药物研发领域的8点专家共识,填补了类器官领域的空白,标志着中国研究者在全球类器官研究中的领先地位。该专家共识是患者来源类器官(Patient-derived organoids, PDOs)在药物研发与精准医疗中应用相关的首篇英文专家共识,重新定义了PDOs药物敏感性检测(Drug sensitivity testing, DST)概念,提出了PDOs-DST在肿瘤精准医疗和药物研发领域的8点专家共识,并肯定了类器官在临床前药物研发和临床精准医疗中的应用可行性,首次明确规范了PDOs在药物研发与精准医疗两个领域的具体应用场景与条件,展望了未来在严格的监管制度下类器官技术的巨大潜力,为将来类器官临床应用指南的制定提供重要的理论支持。
北京佰司特科技有限责任公司 (https://www.best-sciences.com):
类器官串联芯片培养仪-HUMIMIC;灌流式细胞组织类器官代谢分析仪-IMOLA;光片显微镜-LSM-200;
蛋白稳定性分析仪-PSA-16;单分子质量光度计-TwoMP;超高速视频级原子力显微镜-HS-AFM;
全自动半导体式细胞计数仪-SOL COUNT;农药残留定量检测仪—BST-100;台式原子力显微镜-ACST-AFM;微纳加工点印仪-NLP2000/DPN5000;
- 2024-11-10
- 2024-11-10
- 2024-11-10
- 2024-11-10
- 2024-11-09
- 2024-11-05
- 2024-11-04
- 2024-10-24
- 2024-10-24
- 2024-10-20
- 2024-10-17
- 2024-10-13
- 2024-09-19
- 2024-09-15
- 2024-09-12
